问题
填空题
(10分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
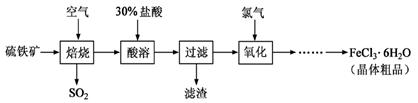
回答下列问题:
(1)过量的SO2与NaOH溶液反应的离子方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的
尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
答案
(每空2分,共10分)(1)SO2+OH=HSO3-
(2)提高铁元素的浸出率 抑制Fe3+水解
(3)Cl2+Fe2+=2Cl-+Fe3+ Cl2和HCl
(1)过量的SO2与NaOH溶液反应,应该是生成亚硫酸氢钠,所以反应的离子方程式是O2+OH=HSO3-。
(2)一方面盐酸过量,可以提高铁元素的浸出率;另一方面,由于氯化铁在溶液中存在水解平衡,所以过量的盐酸可以抑制铁离子的水解,因此酸溶及后续过程中均需保持盐酸过量的目的是提高铁元素的浸出率和抑制Fe3+水解。
(3)溶液中含有亚铁离子,所以通入氯气发生的主要反应的离子方程式是Cl2+Fe2+=2Cl-+Fe3+;由于通入氯气,所以尾气中含有氯气。又因为盐酸易挥发出氯化氢气体,所以尾气中还含有氯化氢气体。



