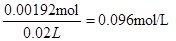(12分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备 CuSO4·5H2O及纳米材料G,主要步骤如下:

已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2 +生成沉淀的pH 分别如下:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
(1)在相同温度时溶度积的相对大小:Ksp[Fe(OH)2]______(填“>”或“<”)Ksp[Cu(OH)2]。
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,目的是氧化_____________(填离子符号)。该工厂选用试剂①最好为下列中的 (填代号)。
a. Na2O2 b. H2O2 c. Cl2 d. KSCN
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是溶液温度控制在_______℃,pH控制在________,氧化时间为________小时左右。

(4)向溶液B中加入试剂②的化学式为_______,操作Ⅰ的名称是_________。
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-被还原为Mn2+,则该反应的离子方程式为_____________________________________________。取A溶液20.00 mL,用去0.0240 mol/L KMnO4溶液16.00 mL时恰好达到滴定终点,则A溶液中Fe2+浓度为 。
(12分)⑴ >(1分) (2) Fe2+ (1分)b (1分)
(3) 80 1.5 4 (3分) (4)CuO(1分) 过滤(1分)
(5)MnO4-+5Fe2++8H+=Mn2++ 5Fe3++4H2O (2分) 0.096mol/L (2分)
(1)由表格数据可看出,Cu2+、Fe2+开始沉淀的PH分别为4.7、7.6,即Cu2+所需OH—的浓度小,由Ksp定义式可知Ksp[Cu(OH)2]相对较小。
(2)要制备硫酸铜,则必须出去铁离子和亚铁离子。根据表中数据可知要通过沉淀法直接出去亚铁离子,则铜离子也将被同时除去,所以应该把亚铁离子氧化生成铁离子,然后再通过沉淀法出铁离子。因为当氢氧化铁完全沉淀后,铜离子还留在溶液中。所选择的氧化剂不能再引入新的杂质,所以应该选择绿色氧化剂双氧水。
(3)根据图像可知,在80℃pH等于1.5时转化率最高,所以应该控制的条件就是溶液温度控制在80℃,PH控制在1.5,氧化时间为4小时左右。
(4)要得到氢氧化铁沉淀,就有增大溶液的pH,同时还不能引入杂质,所以可选择氧化铜。要分离固液混合物,需要过滤。
(5)参加反应的高锰酸钾是0.0240mol/L×0.016L=0.000384mol,高锰酸钾氧化亚铁离子的方程式为MnO4-+ 5Fe2+ + 8H+="==" Mn2+ + 5Fe3+ + 4H2O,所以消耗的亚铁离子为0.000384mol×5=0.00192mol,所以浓度为