【化学——选修2:化学与技术】(15分)碳酸锂用途广泛,可用作陶瓷、药物、催化剂,也是常用的锂离子电池的原料。工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:

已知:①Li2O·Al2O3·4SiO2+H2SO4(浓)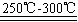 Li2SO4+Al2O3·H2O↓
Li2SO4+Al2O3·H2O↓
②某些物质的溶解度(S)如下表所示。

(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。
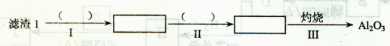
则步骤I中反应的离子方程式是 ,步骤Ⅱ应通入一种气体试剂为 ,步骤II反应完之后需要的操作是 。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液l中加入石灰乳的作用是(用离子方程式表示) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗产品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过 量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。
(1)Al2O3 +6H+ = 2Al3++3H2O(2分) NH3 (2分) 过滤(2分)
(2)Ca(OH)2 + 2H+ = Ca2+ + 2H2O(1.5分)Ca(OH)2(s) + Mg2+ Mg(OH)2(s) +Ca2+(1.5分)
Mg(OH)2(s) +Ca2+(1.5分)
(3) Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失(2分)
(4)① 2Cl-―2e-=Cl2↑(2分)② 2LiOH+2NH4HCO3=Li2CO3↓+(NH4)2CO3+2H2O(2分)
本题考查元素化合物的性质及化学与技术有关知识。(1)用酸将Al2O3溶液解,再通入氨气转化为Al(OH)3沉淀,过滤后灼烧得到Al2O3,步骤I中反应的离子方程式是Al2O3 +6H+ = 2Al3++3H2O,通入的气体物质是NH3,步骤II反应完之后需要的操作是过滤。(2)向滤液l中加入石灰乳的作用是调节溶液的pH值并将Mg2+转化为难溶的Mg(OH)2沉淀,反应的离子方程式为Ca(OH)2 + 2H+ = Ca2+ + 2H2O,Ca(OH)2(s) + Mg2+ Mg(OH)2(s) +Ca2+。(3)从表中数据可知,Li2CO3的溶解度随温度升高而减小,故用热水洗涤能减少Li2CO3的损失,保证更高的产率。(4)①Li2CO3溶于盐酸,得到LiCl溶液,电解时,阳极Cl-失电子被子氧化,电极反应式为2Cl-―2e-=Cl2↑,Li+通过半透膜进入阴极区,得到LiOH溶液。②电解后得到LiOH溶液,加入NH4HCO3,将LiOH转化为Li2CO3,反应的化学方程式是2LiOH+2NH4HCO3=Li2CO3↓+(NH4)2CO3+2H2O。
Mg(OH)2(s) +Ca2+。(3)从表中数据可知,Li2CO3的溶解度随温度升高而减小,故用热水洗涤能减少Li2CO3的损失,保证更高的产率。(4)①Li2CO3溶于盐酸,得到LiCl溶液,电解时,阳极Cl-失电子被子氧化,电极反应式为2Cl-―2e-=Cl2↑,Li+通过半透膜进入阴极区,得到LiOH溶液。②电解后得到LiOH溶液,加入NH4HCO3,将LiOH转化为Li2CO3,反应的化学方程式是2LiOH+2NH4HCO3=Li2CO3↓+(NH4)2CO3+2H2O。
