下表是元素周期表的一部分,针对表中的 ①~⑩中元素,用元素符号或化学式填空回答以下问题:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)化学性质最不活泼的元素的原子结构示意图为
(3)元素的最高价氧化物对应的水化物中酸性最强的酸是 ,碱性最强的碱是 ,呈两性的氢氧化物是 ;
(4)在③~⑦元素中,原子半径最大的是 ,原子半径最小的是 ;
(5)在⑦与⑩的单质中,氧化性强的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): .
由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
(1)周期表中从左到右失电子能力逐渐减弱,得电子能力逐渐增强,从上到下失电子能力逐渐增强,得电子能力逐渐减弱,所以失电子能力最强的是K,得电子能力最强的是F,得电子能力强则元素的非金属性就强,故答案为:K;F;
(2)上述元素中只有Ar原子的最外层电子数为8,性质不活泼,原子结构示意图为:
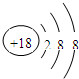
,故答案为:
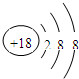
;
(3)根据元素周期律:周期表中从左到右失电子能力逐渐减弱,得电子能力逐渐增强,元素非金属性逐渐增强,从上到下失电子能力逐渐增强,得电子能力逐渐减弱,元素非金属性逐渐减弱,上述元素中Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强,Al(OH)3为两性氢氧化物,
故答案为:HClO4;KOH;Al(OH)3;
(4)同一周期,元素原子半径从左到右半径在减小,则Na的原子半径最大,Cl的最小,故答案为:Na;Cl;
(5)同主族从上到下,单质的氧化性逐渐增强,所以氯气的氧化性强于溴单质,可以通过水溶液中的置换反应来证明,即2NaBr+Cl2=2NaCl+Br2,
故答案为:Cl2;2NaBr+Cl2=2NaCl+Br2.
