(12分)综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示:
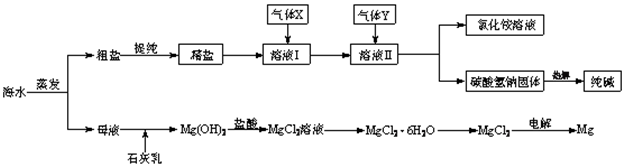
(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤ ;⑥加适量的盐酸;⑦ 。
(2)溶液Ⅱ中发生反应的化学方程式是: 。
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用___ ___ 溶液进行洗涤以除之。
(4)高温灼烧六水合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式________ __ 。
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为:_____ _______。
(1)过滤 蒸发结晶(只写“蒸发”给分,只写“结晶”不给分)
(2)NaCl + NH3 + CO2 + H2O=NaHCO3 + NH4Cl(2分,不追究沉淀符号)
(3)MgCl2或写“氯化镁”
(4)MgCl2·6H2O MgO+ 2HCl↑+5H2O↑ (5)Cl2 + 2Br—=2Cl—+ Br2
MgO+ 2HCl↑+5H2O↑ (5)Cl2 + 2Br—=2Cl—+ Br2
(1)考查粗盐的提纯加入碳酸钠溶液之后,溶液中含有硫酸钡、氢氧化镁和碳酸钡以及碳酸钙沉淀,需要通过过滤除去。酸化后通过蒸发结晶即得到氯化钠。
(2)根据生成物碳酸氢钠和氯化铵可知,反应的方程式为NaCl + NH3 + CO2 + H2O=NaHCO3 + NH4Cl,
(3)由于氢氧化镁的溶解度小于氢氧化钙的,所以要除去氢氧化镁中的氢氧化钙,可以加入氯化镁生成氢氧化镁和氯化钙而除去。
(4)氯化镁在溶液中存在水解平衡,水解是吸热的,所以直接加热得不到氯化镁,而是得到氧化镁,方程式为MgCl2·6H2O MgO+ 2HCl↑+5H2O↑。
MgO+ 2HCl↑+5H2O↑。
(5)氯元素的非金属性强于溴元素的,所以氯气能把溴离子氧化生成溴单质,方程式为Cl2 + 2Br—=2Cl—+ Br2。
