用芒硝(Na2SO4 °10H2O)制备纯碱、明矾铵[(NH4)2Al(SO4)2°12H2O]的生产工艺流程如下图:
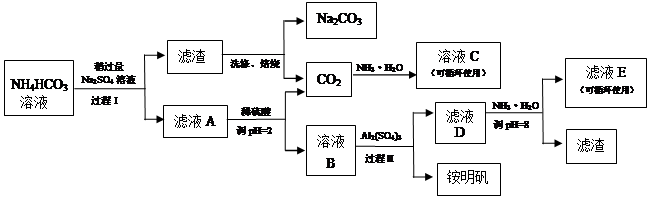
(1)溶液C中的溶质主要是_____________
(2)明矾铵的溶液呈_____性,明矾铵可用于净水,用离子方程式说明其原理______________________
(3)过程Ⅰ中的反应温度不能超过40℃,其原因是______________________________
(4)运用化学平衡原理解释Na2SO4稍过量的原因
(5)若将Al2(SO4)3加入到A中会产生大量的沉淀和气体,导致明矾铵的产量降低,请用离子方程式解释产生该现象的原因是___________________________________________
(6)溶液E中的溶质离子为__________________
(7)已知明矾铵的溶解度随着温度的升高而增大,过程Ⅱ中得到明矾铵的系列实验操作是: 、 、过滤、洗涤、干燥。
(1) NH4HCO3
(2)酸 Al3+ + 3H2O Al(OH)3 + 3H+
Al(OH)3 + 3H+
(3)NH4HCO3易受热分解
(4)HCO32—(aq)+ Na+(aq) NaHCO3(s),Na+浓度增大平衡向正反应方向移
NaHCO3(s),Na+浓度增大平衡向正反应方向移
(5)Al3+ + 3HCO32— =Al(OH)3↓ + 3CO2↑
(6)NH4+ 、SO42—
(7)蒸发浓缩、冷却结晶
题目分析:该题为工业流程题,经过一系列反应,提纯、结晶得到。(1)CO2与氨水反应生成NH4HCO3或(NH4)2CO3;(2)由于Al3+ 与NH4+水解使溶液呈现酸性,明矾铵可用于净水,是因为铝离子水解产生氢氧化铝胶体所致,Al3+ + 3H2O Al(OH)3 + 3H+;(3)NH4HCO3易受热分解,故反应应控制温度;(4)在平衡体系中增加一种反应物的浓度,反应正向进行,提高另外反应物的转化率;(5)双水解反应;(6)A为(NH4)2SO4和剩余的硫酸盐和碳酸盐,B主要为NH4HSO4,D主要为剩余的NH4HSO4、Al2(SO4)3,E为(NH4)2SO4;(7)明矾铵的溶解度随着温度的升高而增大,故采用降温结晶的方法分离,因滤液浓度低,所以需要浓缩,方法为蒸发浓缩、降温结晶(冷却结晶)。
Al(OH)3 + 3H+;(3)NH4HCO3易受热分解,故反应应控制温度;(4)在平衡体系中增加一种反应物的浓度,反应正向进行,提高另外反应物的转化率;(5)双水解反应;(6)A为(NH4)2SO4和剩余的硫酸盐和碳酸盐,B主要为NH4HSO4,D主要为剩余的NH4HSO4、Al2(SO4)3,E为(NH4)2SO4;(7)明矾铵的溶解度随着温度的升高而增大,故采用降温结晶的方法分离,因滤液浓度低,所以需要浓缩,方法为蒸发浓缩、降温结晶(冷却结晶)。
