回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图:
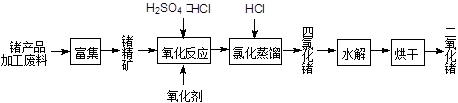
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是 。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、 、 、接收管、锥形瓶等。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为 。
温度对GeCl4的水解率产生的影响如图1所示,其原因是 。 为控制最佳的反应温度,实验时可采取的措施为 (填序号)。
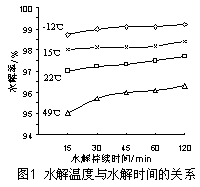
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 。
| pH | 4 | 5 | 6 | 7 | 8 | 9 |
| 溶解率/% | 47.60 | 32.53 | 11.19 | 5.27 | 1.96 | 8.85 |
(15分)(1)Ge2++H2O2+2H+=Ge4++2H2O(2分)
(2)抑制GeCl4水解 温度计 冷凝管(各1分)
(3)GeCl4+ (2+n) H2O = GeO2·nH2O↓+ 4HC1 该水解反应是一个放热反应 C(各2分)
(4)二氧化锗具有两性 GeO2+2OH-= GeO32-+H2O (各2分)
题目分析:(1)锗元素由+2升为+4价,则 Ge2+是还原剂,H2O2是氧化剂,氧元素由—1降为—2价,则还原产物为H2O,根据电子、电荷和原子守恒配平,则Ge2++H2O2+2H+=Ge4++2H2O;(2)GeCl4是强酸弱碱盐,在水溶液中能水解,加入浓盐酸能使其水解平衡左移,抑制其水解,防止其变质;蒸馏主要用到的仪器是酒精灯、蒸馏烧瓶、铁架台、温度计、冷凝管、接收器、锥形瓶;(3)GeO2·nH2O是水解产物,设其系数为1,根据锗原子、氯原子、氢原子、氧原子守恒,则该水解反应为GeCl4+ (2+n) H2O = GeO2·nH2O+ 4HC1;读图,升高温度,GeCl4的水解率减小,前者能使平衡向吸热反应方向移动,后者说明平衡向逆反应方向移动,则逆反应是吸热反应,所以正反应速率是放热反应;读图可知,—12℃时GeCl4的水解率最高,所得产品的产率最大;冰水混合物的温度约为0℃,故A错误;49℃时GeCl4的水解率最小,所得产品的产率最小,故B错误;冰盐水的温度可能为—12℃,故C正确;(4)铝、锗均位于元素周期表中金属与非金属交界线附近,铝是锗左上角相邻元素,则锗的性质与铝相似,由此推断GeO2与Al2O3相似,都是两性氧化物;由于Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-=2AlO2-+H2O,由此可仿写出GeO2+4H+=Ge4++2H2O、GeO2+2OH-=GeO32-+H2O,前者是pH<8时GeO2溶解率增大的主要原因,后者是pH>8时GeO2溶解率增大的主要原因。
