钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
(1)化合物FeTiO3中铁元素的化合价是 。
(2)滤渣A的成分是 。
(3)滤液B中TiOCl42- 转化生成TiO2的离子方程式是 。
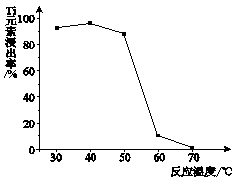
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如下图所示。反应温度过高时,Ti元素浸出率下降的原因是 。
(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12+3LiFePO4 Li7Ti5O12+3FePO4
Li7Ti5O12+3FePO4
该电池充电时阳极反应式是 。
(12分,每空2分)
(1)+2
(2)SiO2
(3)TiOCl42-+H2O  TiO2↓+2H++4Cl-
TiO2↓+2H++4Cl-
(4)温度过高时,反应物氨水(或双氧水)受热易分解
(5) (NH4)2Ti5O15+2LiOH=Li2Ti5O15↓+2NH3·H2O(或2NH3+2H2O)
(6)20/9(1分)
(7)LiFePO4 – e-=FePO4+Li+(1分)
题目分析:(1)根据题目所给信息:可表示为FeO·TiO2,可知Fe的化合价为:+2。
(2)FeTiO3、MgO、CaO与HCl反应,剩下的固体只有SiO2。
(3)过滤后未加其他反应物,所以TiOCl42-与H2O反应,生成TiO2,同时生成H+、Cl‾。
(4)TiOCl42- 转化为TiO2时,需要加入反应物双氧水、氨水,这两种物质受热易分解。
(5)(NH4)2Ti5O15为铵盐,LiOH为强碱,发生复分解反应,根据反应规律,即可写出化学方程式。
(6)分析反应流程,H2O2把Fe2+氧化为Fe3+,H2C2O4把Fe3+还原为Fe2+,H2O2中O由-1价变为-2价,H2C2O4由+3价变为+4价,根据电子转移总数相等得:m(H2O2)×17÷200g/mol×2=m(H2C2O4)÷90g/mol×2,得m(H2O2):m(H2C2O4)= 20/9。
(7)电池充电时阳极反应为失电子反应,LiFePO4中Fe失去1个电子,由+2价变为+3价,生成FePO4,同时得到Li+。
