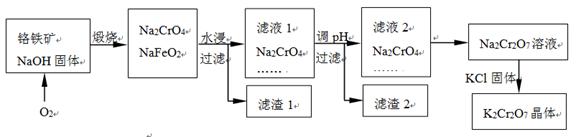
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。 ② Cr2O72-+ H2O  2CrO42- + 2H+
2CrO42- + 2H+
 K2Cr2O7中Cr元素的化合价是 。
K2Cr2O7中Cr元素的化合价是 。
生成滤渣1中红褐色物质反应的化学方程式是 。
滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式) 。
利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是 。
由滤液2转化为Na2Cr2O7溶液应采取的措施是 。
向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、 、过滤、洗涤、干燥。
煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
+6 (1分) ;NaFeO2+2H2O→Fe(OH)3↓+NaOH; NaOH、NaAlO2
2Al2O3(熔融)  4Al + 3O2↑ 加硫酸酸化;冷却结晶 (1分)
4Al + 3O2↑ 加硫酸酸化;冷却结晶 (1分)
4FeO·Cr2O3 + 7O2 + 20NaOH 8Na2CrO4 + 4NaFeO2+ 10H2O
8Na2CrO4 + 4NaFeO2+ 10H2O
题目分析:(1)根据化合物化合价的代数和为0可知,K2Cr2O7中Cr元素的化合价是+(2×7-1×2)÷2=+6价。
(2)由于NaFeO2遇水强烈水解,则生成滤渣1中红褐色物质反应的化学方程式是NaFeO2+2H2O→Fe(OH)3↓+NaOH。由于矿石中还含有氧化铝,且氢氧化钠是过量的,则滤液1的成分除Na2CrO4、Na2SiO3外,还含有NaOH、NaAlO2。
(3)由于滤液中含有偏铝酸钠,则可以制备氧化铝,电解熔融的氧化铝可以制备金属铝,反应的化学方程式是2Al2O3(熔融)  4Al + 3O2↑.
4Al + 3O2↑.
(4)根据方程式Cr2O72-+ H2O 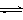 2CrO42- + 2H+可知,由滤液2转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化;获得K2Cr2O7晶体的操作依次是:加热浓缩、冷却结晶、过滤、洗涤、干燥。
2CrO42- + 2H+可知,由滤液2转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化;获得K2Cr2O7晶体的操作依次是:加热浓缩、冷却结晶、过滤、洗涤、干燥。
(5)根据原子守恒可知,煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是4FeO·Cr2O3 + 7O2 + 20NaOH 8Na2CrO4 + 4NaFeO2+ 10H2O。
8Na2CrO4 + 4NaFeO2+ 10H2O。
点评:该题是高考中的常见题型,难度大,综合性强,对学生的要求高。试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范严谨的实验设计能力以及评价能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
