一种含铝、锂、钴的电子废料中,铝以铝箔的形式存在,钴以Co3O4的形式存在(吸附在铝箔的单面或双面),锂混杂于其中。从该废料中回收Co3O4的工艺流程如下:
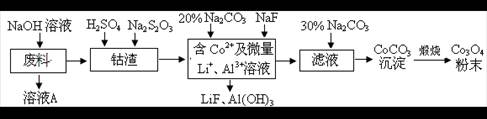
(1)溶液A的溶质的主要成分为 。(填化学式)
(2)钴渣中加入稀H2SO4酸化后,再加入Na2S2O3溶液可以浸出钴离子,则浸出钴离子的离子方程式为(产物中只有一种酸根) 。
(3)在实验室模拟工业生产时,也可用盐酸浸出钴离子,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴离子的主要原因: 。
(4)加入NaF的反应为:Li++F- LiF↓,该反应的平衡常数表达式为K= 。
LiF↓,该反应的平衡常数表达式为K= 。
(5)加入30%Na2CO3溶液的作用是 。
(6)在空气中锻烧CoCO3生成Co3O4的化学方程式是 。
(1)NaAlO2、LiOH
(2)4Co3O4 + S2O3 2-+ 22H+=12Co2++ 2SO42-+ 11H2O
(3)Co2O3·CoO可氧化盐酸产生Cl2污染环境(或盐酸挥发污染环境。合理答案均可)
(4)1/[c(Li+) ·c(F-)]
(5)沉淀钴离子(或形成CoCO3沉淀)
(6)6CoCO3+O2 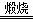 2Co3O4+6CO2
2Co3O4+6CO2
题目分析: (1)铝与氢氧化钠溶液生成偏铝酸钠和氢气、锂与水生成氢氧化锂和氢气,溶液A主要成分为NaAlO2和LiOH。(2)由流程可知,滤液中加入碳酸钠溶液后生成CoCO3沉淀,所以四氧化三钴与S2O32-生成Co2+,S2O32-被氧化为SO42-,根据得失电子相等、电荷守恒、质量守恒配平。(3)四氧化三钴具有氧化性,能将盐酸氧化生成氯气,污染环境。(4)LiF为固体,其浓度不列入平衡常数表达式。(5)碳酸钠溶液与Co2+生成CoCO3沉淀。(6)CoCO3与氧气生成四氧化三钴和二氧化碳。