海洋是资源的宝库,海水中几乎存在所有的天然元素。海洋资源化学就是研究从海洋中提取化学物质的学科,除了研究从海洋中提取常量元素外,还研究从海洋中提取微量元素(浓度小于1mg/L)。
(1)海洋中含量最高的卤素元素在周期表中的位置为 ;与其同周期相邻且单质为固体的元素原子的核外电子排布式为 。
(2)海洋中元素含量位于前列的元素有氧、氯、钠、镁、硫,其离子半径从大到小的顺序为 (用离子符号表示),其中形成的化合物中能发生潮解的是 (用电子式表示)。
(3)微量元素铍在海水中主要以Be(OH)+形式存在,其性质与铝元素相似,目前是从绿宝石(主要成分为铍铝硅酸盐Be3Al2Si6O18)中提取,由于铍是航空、电子、汽车等工业不可替代的战略金属材料,因此海水提铍会成为海洋资源化学新的研究方向。请写出:
①铍铝硅酸盐的氧化物形式的化学式: 。
②Be(OH)+与强碱溶液反应的离子方程式: 。
(4)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是 (选填编号)。
a.海水提溴:海水浓缩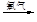
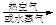 溴蒸气
溴蒸气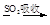
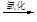
 液溴
液溴
b.海水提镁:海滩贝壳
 石灰乳
石灰乳
 MgO
MgO 镁
镁
c.海带提碘:海带灼烧
 滤液
滤液 含碘有机溶液
含碘有机溶液 碘晶体
碘晶体
d.海盐提纯:海盐
 精盐
精盐
 滤液
滤液
 食盐晶体
食盐晶体
(本题8分)(1)第三周期ⅦA族 1s22s22p63s23p4
(2)S2->Cl->O2->Na+>Mg2+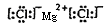
(3)3BeO·Al2O3·6SiO2 Be(OH)++3OH-→BeO22-+ 2H2O (4)bd(2分)
题目分析:(1)海洋中含量最高的卤素元素是氯元素,其原子序数是17,在周期表中的位置为第三周期ⅦA族;与其同周期相邻且单质为固体的元素是S,原子序数是16,根据构造原理可知S原子的核外电子排布式为1s22s22p63s23p4。
(2)电子层数越多离子半径越大。在核外电子排布相同的条件下,离子半径随原子序数的增大而减小,所以氧、氯、钠、镁、硫,其离子半径从大到小的顺序为S2->Cl->O2->Na+>Mg2+。其中形成的化合物中能发生潮解的是氯化镁,含有离子键的离子化合物,其电子式是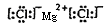 。
。
(3)①再用氧化物形式表示时,活泼金属的氧化物在前面,然后以此类推,所以根据铍铝硅酸盐的化学式Be3Al2Si6O18可知,其氧化物形式可表示为3BeO·Al2O3·6SiO2。
②由于铍元素以及化合物的性质与铝元素以及化合物的性质相似,所以根据氢氧化铝与氢氧化钠溶液反应的方程式可知,Be(OH)+与强碱溶液反应的离子方程式为Be(OH)++3OH-→BeO22-+ 2H2O。
(4)根据流程图可知,ac正确;工业电解氯化镁冶炼金属镁,而不是电解氧化镁,因为氧化镁的熔点太高,b不正确;d中氯化钡过量,引入了杂质Ba2+离子,所以得不到纯净的氯化钠,应该先加氯化钡,后加碳酸钠,过滤后加入盐酸酸化,d不正确,答案选bd。
