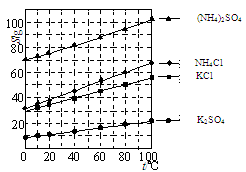
K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:
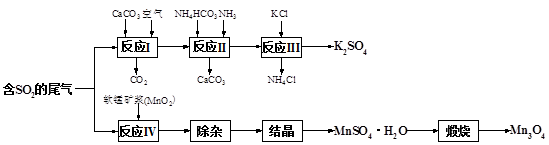
(1)几种盐的溶解度见图。反应III中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、 、洗涤、干燥等操作即得K2SO4产品。
(2)检验K2SO4样品是否含有氯化物杂质的实验操作是: 。
(3)反应IV的化学方程式为 。
(4)Mn3O4与浓盐酸加热时发生反应的离子方程式为 。
(5)下图是煅烧MnSO4•H2O时温度与剩余固体质量变化曲线。
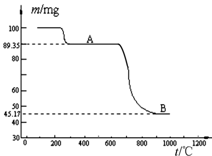
①该曲线中B段所表示物质的化学式为 。
②煅烧过程中固体锰含量随温度的升高而增大,但当温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因: 。
(1)趁热过滤
(2)取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液
(3)MnO2+SO2=MnSO4
(4)Mn3O4+8H++2Cl- 3Mn2++Cl2↑+4H2O
3Mn2++Cl2↑+4H2O
(5)①Mn3O4②部分Mn3O4又被氧化为Mn2O3或MnO2,造成总锰含量减小
题目分析:(1)四种物质中相同温度下硫酸钾溶解度最小,所以反应III中蒸发浓缩后硫酸钾析出,趁热过滤得硫酸钾晶体,再洗涤、干燥即可。(2)检验Cl-一般用硝酸银溶液和稀硝酸,但SO42-也能与Ag+形成硫酸银沉淀,所以检验Cl-前要先加过量硝酸钡溶液将SO42-沉淀,过滤后向滤液中加硝酸银溶液看是否产生白色沉淀。(3)二氧化锰与二氧化硫生成硫酸锰。(4)Mn常见价态有+2、+4、+6、+7,四氧化三锰可改写为MnO2·2MnO,MnO2与浓盐酸生成MnCl2、Cl2和H2O、MnO与盐酸生成MnCl2和H2O。(5)由流程图可知硫酸锰晶体锻烧得到四氧化三锰,根据图中数据,由Mn守恒确认B为四氧化三锰。温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小原因可能是四氧化三锰被氧化为二氧化锰或三氧化二锰,使锰含量减小。

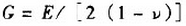 成立的条件是()。
成立的条件是()。