金属锂是原子能工业和新能源工业中的重要物质。工业上常用β—辉锂矿(主要成分是LiAlSi2O6,含有少量钙、镁杂质)制备金属锂,其生产流程如下:
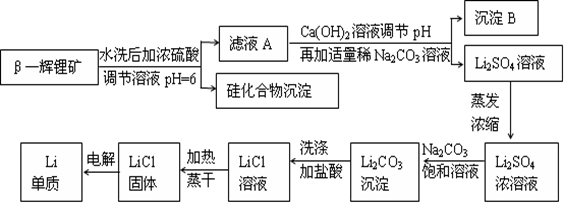
已知Li2CO3微溶于水。请回答下列问题:
(1)写出LiAlSi2O6与硫酸反应的化学方程式_______________________。
(2)沉淀B的主要成分是_____________(写化学式)。
(3)蒸发浓缩Li2SO4溶液时,需要使用的硅酸盐质仪器有蒸发皿、_________和_________。
(4)上述生产流程中蒸发浓缩Li2SO4溶液的目的是____________________。
(5)金属锂用于锂电池时,常用FeF3作其正极的活性物质,FeF3常用FeCl3与40%HF溶液反应制备。在制备过程中需要选用特制聚四氟乙烯材料的容器进行反应,而不是用普通的玻璃仪器或陶瓷仪器,其原因是_________________________________(用化学反应方程式表示)。
(6)金属锂可用于储存氢气,其原理是:①2Li+H2=2LiH,②LiH+H2O=LiOH+H2↑。若已知LiH的密度为0.82g·cm-3,用金属锂吸收224L H2(标准状况)恰好完全反应,则生成的LiH的体积与被吸收的氢气的体积之比为1: ______(精确到整数)。
(1) 2LiAlSi2O6+4H2SO4=Li2SO4+Al2(SO4) 3+4H2SiO3↓(2分)。
(2) Al(OH)3和CaCO3 (2分) (3)酒精灯(1分) 玻璃棒(1分)。
(4)碳酸锂微溶于水,蒸发浓缩的目的是增大溶液中锂离子浓度,使锂离子浓度与碳酸根离子浓度之积大于Ksp(Li2CO3),以便产生碳酸锂沉淀。(3分)
(5)SiO2+4HF=SiF4↑+2H2O(2分)。(6) 1148(2分)。
题目分析:β—辉锂矿溶于硫酸生成硫酸锂、硫酸铝、和硅酸沉淀,过滤除去硅酸,滤液中加入Ca(OH)2和Na2CO3后生成CaCO3和Al(OH)3就是沉淀B,过滤,得到硫酸锂溶液,蒸发浓缩后,加入Na2CO3得到Li2CO3沉淀,加盐酸得到LiCl,电解得锂。(6)吸收氢气10摩尔,生成LiH20摩尔,质量是160克,体积是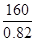 毫升,氢气体积22400毫升,体积比为1:1148
毫升,氢气体积22400毫升,体积比为1:1148
