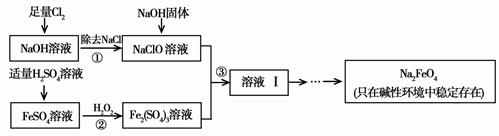
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种比氯气更好的净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下,回答下列问题:
(1)氯气作净水消毒剂是因为它溶于水生成了________,它有强的氧化性,能杀菌消毒。
(2)步骤②反应的离子方程式是 。
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为 。
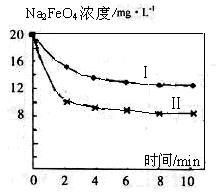
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线II比曲线I对应的污水pH________(填“高”或“低”)。
(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_____倍
(1)次氯酸或HClO (2)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
(3)2Fe3+ + 3ClO- + 10OH- = 2FeO42- + 3Cl- + 5H2O (4)低 (5)0.64。
题目分析:(1)氯气在水中发生反应:Cl2+H2O="HCl+HClO." HclO有强的氧化性,能对水杀菌、消毒。(2)H2O2有强的氧化性,在酸性条件下把Fe2+氧化成Fe3+,它本身被还原为H2O。步骤②反应的离子方程式是2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O。(3)ClO-能在碱性条件下把Fe3+氧化成FeO42-,它本身被还为Cl-。步骤③中反应的离子方程式为2Fe3+ + 3ClO- + 10OH- = 2FeO42- + 3Cl- + 5H2O 。(4)FeO42-在酸性条件下氧化能力比碱性条件下强,浓度变化大。所以曲线II比曲线I对应的污水pH小,即酸性强。(5)Na2FeO4的消毒效率是:3NA÷166;氯气的消毒效率是:2NA÷71.所以Na2FeO4的消毒效率与氯气消毒效率之比为:(3NA÷166):(2NA÷71)=0.64..2FeO4)的制法、消毒效率及相应的化学反应原理。
