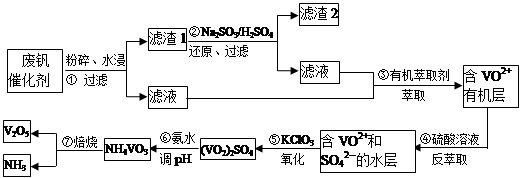
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2)中钒的主要流程如下:
已知:(1)V2O5和NH4VO3均为难溶物,VOSO4和(VO2)2SO4均为易溶物。
(2) 2VO2++H2C2O4+2H+ = 2VO2+ + 2CO2↑+ 2H2O
回答下列问题:
(1)步骤①前,粉碎的目的是_________________________。
(2)步骤②中发生反应的离子方程式为__________________________。
(3)步骤③的变化过程可简化为(HA表示有机萃取剂):
VOSO4 (水层)+ 2HA(有机层)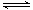 VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是_____________。
VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是_____________。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定操作⑤后溶液中含钒量的步骤为:取10.0mL0.1mol/LH2C2O4溶液于锥形瓶中,加入指标剂,将待测液盛放在滴定管中,滴定到终点时,消耗待测液的体积为10.0mL,由此可知(VO2)2SO4溶液钒元素的含量为_________g/L。
(5)V2O5可用金属(如Ca、Al)热还原法获得钒,则金属铝热还原制得钒的化学方程式为_______________。
(1)增大固液接触面积,加快浸出速率,提高浸出率(2分)
(2)V2O5+ SO32-+4H+=2VO2+ + SO42-+2H2O(2分)
(3)加入硫酸,可使平衡向左进行,使VOSO4进入水层;(2分)
(4)10.2g/L (2分)
(5)3V2O5+10Al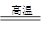 6V+5Al2O3(2分)
6V+5Al2O3(2分)
题目分析:(1)粉碎固体反应物,可以增大固液接触面积,加快浸出速率,提高浸出率。
(2)亚硫酸根具有还原性,酸性条件下,能被五氧化二钒氧化生成硫酸根离子,离子反应方程式为:V2O5+ SO32-+4H+=2VO2+ + SO42-+2H2O
(3)加入H2SO4,H2SO4浓度增大,步骤③化学平衡向向左移动,使VOSO4进入水层。
(4)根据题目所给信息:2VO2+ ~ H2C2O4,可知(VO2)2SO4溶液钒元素的含量为:0.1mol/L×0.01L×2×51g/mol÷0.01L= 10.2g/L。
(5)铝与五氧化二钒反应生成钒与氧化铝,化学方程式为:3V2O5+10Al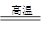 6V+5Al2O3
6V+5Al2O3
