海洋是一个巨大的化学资源宝库,下图是海水加工的示意图:

(1)海水淡化工厂通常采用的制备淡水的方法有 (写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中试剂A的化学式 ,
 溶液中发生反应的化学方程式为 。
溶液中发生反应的化学方程式为 。

(3)制备金属镁是通过电解熔融的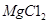 ,而不用MgO,其原因是
,而不用MgO,其原因是
。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和Cl2。海水中得到的粗盐往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,阳离子交换膜的作用是 。
(1)蒸馏法、电渗析法
(2)Cl2 3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑
(3)MgO熔点很高,会消耗大量电能
(4)用试剂处理后的盐水中还含有少量的Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜;防止H2与Cl2混合发生爆炸,同时防止Cl‾进入阴极室,这样可以获得纯净的NaOH
题目分析:(1)海水淡化工厂通常采用的制备淡水的方法有:蒸馏法、电渗析法。
(2)A的作用为把Br‾氧化为Br2,所以A为Cl2;Br2在Na2CO3溶液中发生歧化反应生成NaBr、NaBrO3,化学方程式为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑
(3)MgO的沸点大于MgCl2,会消耗大量电能,为节约能源,应电解熔融的MgCl2,而不用MgO
(4))用试剂处理后的盐水,杂质并没有除彻底,还含有少量的Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜;阳离子交换膜只允许阳离子通过,Cl‾、Cl2与H2不能通过,所以可防止H2与Cl2混合发生爆炸,同时防止Cl‾进入阴极室,这样可以获得纯净的NaOH。
