A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的-1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸.请根据以上信息回答下列问题.
(1)B元素在元素周期表中的位置是第______周期______族.
(2)画出D元素的原子结构示意图______.
(3)与E的氢化物分子所含电子总数相等的分子是______(举一例、填化学式,下同)、离子是______.
(4)A与C形成的化合物中含有化学键的类型是______.
(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为______.
(1)B的+1价阳离子与氖原子具有相同的电子层结构,所以B是金属Na,在第三周期第ⅠA族,故答案为:三;ⅠA;
(2)C的-1价阴离子都与氖原子具有相同的电子层结构,所以C是F,D在F的下一周期,可与Na形成BD型离子化合物,即为氯化钠,D为Cl,原子结构示意图为:
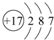
,
故答案为:
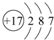
;
(3)E和F为同一周期元素,其最高价氧化物对应的水化物为一种强酸即为硝酸,所以E是N,E的氢化物是氨气,10电子结构,所含电子总数相等的分子有H2O、CH4、HF等,离子有Na+、O2-、OH-、Mg2+、Al3+等,故答案为:H2O(CH4、HF);OH-(Mg2+、Al3+、Na+、O2-);
(4)A是相对原子质量最小的元素即为H,H和F形成的是含有共价键的共价化合物,故答案为:共价键;
(5)氯气和氢氧化钠反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,故答案为:Cl2+2OH-=ClO-+Cl-+H2O.
