某研究性学习小组设计了一组实验来探究ⅦA元素的原子得电子能力强弱规律.下图中A、B、C是三个可供选择制取氯气的装置,D的玻璃管中①②③④依次放置蘸有NaBr溶液、淀粉碘化钾溶液、NaOH浓溶液和品红溶液的棉球,完成下列问题:
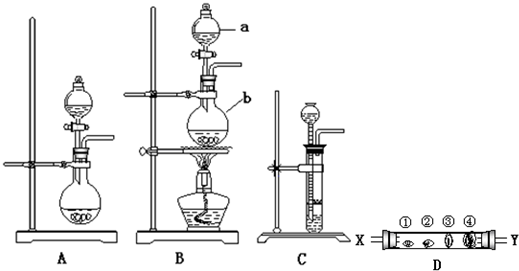
(1)写出装置B中指定仪器的名称:a______; b______
(2)该小组查阅资料显示实验室制取氯气还可采用下列原理:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
根据该原理需要选择A、B、C装置中的______装置制取氯气.
(3)反应装置的导气管与D装置的______导管(选X或Y),写出D装置中
①处棉球的离子反应方程式:______;
②处棉球的现象:______;
③处棉球的离子反应方程式:______;
(4)D装置中④的作用:______.
(5)某同学根据①②两处棉球颜色的变化得出结论:Cl、Br、I原子得电子能力依次减弱,你认为上述实验现象能证明上述结论吗?说明理由.
______.
(1)a为分液漏斗,b为圆底烧瓶,故答案为:分液漏斗;圆底烧瓶;
(2)高锰酸钾与浓盐酸反应较为剧烈,无需加热即可进行,故答案为:A;
(3)检验氯气的性质时,不能先通过NaOH溶液,否则会消耗氯气,且起不到尾气吸收的作用,应从X端进气,
氯气与NaBr溶液反应生成Br2,反应的离子方程式为Cl2+2Br-=2Cl-+Br2,
与碘化钾溶液反应生成I2,反应的离子方程式为Cl2+2I-=2Cl-+I2,棉球变蓝;
氯气在碱性溶液中自身发生氧化还原反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:X;Cl2+2Br-=2Cl-+Br2;棉球变蓝;Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气与水反应生成HClO,具有漂白性,能使品红褪色,把品红放在最后可观察氯气是否被吸收完全,
故答案为:观察氯气是否被吸收完全(其它合理表达均可);
(5)由于不能保证氯气和溴化钠完全反应,则生成的溴单质中含有过量的氯气,则不能证明Br和I得电子能力相对强弱,
故答案为:不能,因为实验无法证明Br和I得电子能力相对强弱.(其它合理表达均可).
