下表是元素周期表的一部分,针对表中的①~=10 ⑩种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | =10 ⑩ | |||
(2)元素②和③非金属性较弱的是______(填元素符号),画出元素③原子结构示意图______.
(3)④和⑧气态氢化物的稳定性较强的是______(填化学式).
(4)在最高价氧化物的水化物中,酸性最强的化合物的分子式是______,碱性最强的化合物的电子式是______.
(5)用电子式表示元素①和⑤所形成化合物的形成过程:______.
(6)⑤⑥⑦三种元素分别形成的单核离子半径由大到小顺序为______(填离子符号).
(7)元素①和④按原子个数比1:1形成的化合物分解的化学方程式______.
(8)写出元素⑦和⑨最高价氧化物的水化物之间反应的离子方程式______.
根据元素周期表中元素的分布情况,知①为H,②为C,③为N,④为O,⑤为F,⑥为Na,⑦为Al,⑧为S,⑨为Cl,⑩为Ar.
(1)稀有气体最外层电子数为2或8,化学性质稳定,故答案为:Ar;
(2)同周期从左到右元素的非金属性逐渐增强,C和N比较,非金属性较弱的是C,N原子核外电子数=核内质子数,结构示意图为:
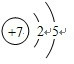
,故答案为:C;
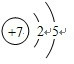
;
(3)同主族从下到上气态氢化物的稳定性逐渐增强,O和S比较,气态氢化物的稳定性较强的是H20,故答案为:H20;
(4)同周期从左到右元素的最高价氧化物的水化物酸性逐渐增强,碱性逐渐减弱,同主族从下到上元素的最高价氧化物的水化物酸性逐渐增强,碱性逐渐减弱,所以酸性最强的是高氯酸HClO4,碱性最强的是氢氧化钠,氢氧化钠试氢氧根离子和钠离子间通过里i帧间形成的离子化合物,电子式为:
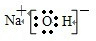
,故答案为:HClO4;
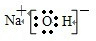
;
(5)氟化氢是氢原子和氟原子间通过共价键形成的共价化合物,形成过程可表示为:
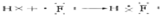
,故答案为:
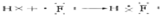
;
(6)F-、Na+、Al3+具有相同的核外电子数,核内质子数越多,半径越小,所以半径大小顺序为:F->Na+>Al3+,
故答案为:F->Na+>Al3+;
(7)氢原子和氧原子按原子个数比1:1形成的化合物双氧水在加热或用二氧化锰作催化剂时可以分解,方程式为:2H2O2
2H2O+O2↑,故答案为:2H2O2 MnO2 .
2H2O+O2↑; MnO2 .
(8)铝的最高价氧化物的水化物是氢氧化铝,氯的最高价氧化物的水化物是高氯酸,属于强酸,氢氧化铝具有两性,可以和强酸反应生成盐和水,实质是:Al(OH)3+3H+═Al3++3H2O,故答案为:Al(OH)3+3H+═Al3++3H2O.
