下表列出了①~⑥六种元素在周期表中的位置:
| 族 周期 | 0 | |||||||
| 1 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
(1)元素⑥的氢化物的电子式是______.
(2)这六种元素中,位于第三周期且原子半径最小的是(填元素符号)______.
(3)这六种元素中,属于两性氧化物的是(填化学式)______.⑤⑥⑦⑧四种元素的最高价氧化物的水化物中,酸性强弱顺序为______.
(4)写出实验室制取元素②的氢化物的化学方程式______.
(5)在盛有水的小烧杯中加入元素③的单质,反应后向溶液中再加入元素④的单质,此时发生反应的离子方程式为______.
由元素在周期表中的位置可知,①为C元素、②为N元素、③为Na元素、④为Al元素、⑤为Si元素、⑥为P元素、⑦为S元素、⑧为Cl元素,
(1)PH3中P原子与H原子之间形成1对共用电子对,电子式为
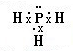
,故答案为:
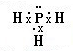
;
(2)同周期自左而右原子半径减小,故原子半径最小的元素是Cl,故答案为:Cl;
(3)Al(OH)3是两性氢氧化物,同周期自左而右非金属性增强,故非金属性Si<P<S<Cl,非金属性越强,最高价氧化物的水化物酸性越强,故酸性HClO4>H2SO4>H3PO4>H2SiO3,
故答案为:Al(OH)3;HClO4>H2SO4>H3PO4>H2SiO3;
(4)实验室利用氯化铵与氢氧化钙加热制备氨气,反应方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O, △ .
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O; △ .
(5)钠与水反应生成氢氧化钠,铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为2A1+2OH-+2H2O=2A1O2-+3H2↑,
故答案为:2A1+2OH-+2H2O=2A1O2-+3H2↑.
