V、W、X、Y、Z五种短周期元素,原子序数依次增大,在周期表中,W、Z属同一主族;X分别与W、Y相邻;V与W,V与Z均可形成原子个数比为4:l的共价化合物.请回答下列问题:
(1)下列比较不正确的是:______;
A.原子半径:Z>W>X>Y>V;
C.沸点:V2Y>XV3>WV4;
B.稳定性:WV4>ZV4;
D.熔点:WY2>ZY2;
(2)WX一与X2属等电子体(微粒电子数相同,结构也相似),则WX一的电子式为:______;
(3)X与Z组成化合物ZnXb熔点高,硬度大,且每个原子皆达到8电子结构,则化合物ZnXb的化学式为:______;其晶体熔化时,所破坏的微粒间相互作用是:______;
(4)工业上用W单质与ZY2在高温下,按物质的量之比为3:1反应,写出该反应的化学方程式:______;
(5)由WV4与Y2、KOH构成燃料电池,放电时,正极区的pH变化是:______(填“升高”,“降低”或“不变”)
(1)A、同周期主族元素自左而右,随原子序数的增大,原子半径减小,所以原子半径C>N>O;同主族自上而下随电子层的增多,原子半径增大,故Si>C,H原子原子半径最小,故原子半径Si>C>N>O>H,故A正确;
B、V2Y为H2O,为液体;XV3为NH3,含有氢键;WV4为CH4,沸点H2O>NH3>CH4,故B正确;
C、WV4为CH4,ZV4为SiH4,二者结构相似,为非金属氢化物,非金属性C>Si,所以稳定性CH4>SiH4,故C正确;
D、WY2为CO2,是分子晶体,ZY2为SiO2,是原子晶体,熔点CO2<SiO2,故D错误.
故选:D.
(2)W为C元素,X为N元素,CN一与N2属等电子体,CN一中碳氮之间为三键,电子式为
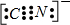
.
故答案为:
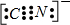
.
(3)X为N元素,Z为Si元素,组成化合物ZnXb中每个原子皆达到8电子结构,1个N原子成与3个Si原子成3个共价键,1个Si原子与4个N原子成4个共价键,N原子与Si原子个数比为4:3,化合物ZnXb的化学式为Si3N4.Si3N4中原子间以共价键结合,晶体熔化时,所破坏的微粒间相互作用共价键.
故答案为:Si3N4;共价键.
(4)W单质为碳单质,ZY2为SiO2,C与按SiO2物质的量之比为3:1反应,反应的化学方程式为3C+SiO2
SiC+2CO↑. 高温 .
故答案为:3C+SiO2
SiC+2CO↑. 高温 .
(5)WV4为CH4,Y2为O2,与KOH构成燃料电池,氧气在正极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,所以正极区的pH升高.
故答案为:升高.
