1919年由Langmuir提出了等电子体.原子数相同、电子数相同的粒子,互称为等电子体.A、B、C、D、E、F 是原子序数依次增大的6种位于元素周期表前20号的元素.B、C、D、E位于同周期.C是空气中含量最多的元素.F与B、D都可形成XY2型离子化合物FB2、FD2,且都可与A2D(无色液体)反应放出气体.B22-与C2是等电子体,D22-与E2是等电子体.F原子的N层电子数与K层电子数相同.
(1)比较C、D、E对应的简单阴离子的半径(用离子符号表示)______(由大到小);
(2)写出能证明D和E非金属性强弱的一个化学方程式______.
(3)由上述6种元素中的4种构成的离子化合物是(写出两种)______,其中所含的化学键类型有______.
(4)写出与C2等电子体的分子的化学式为______,写出B22-的电子式:______
(5)写出FD2与A2D反应的离子方程式:______.
C是空气中含量最多的元素,即为N,F原子的N层电子数与K层电子数相同,即为Ca,F与B、D都可形成XY2型离子化合物FB2、FD2,所以推知B是C,过氧化钙和碳化钙均能和水反应产生氧气,所以D是O,C22-与N2是原子数均为2、电子数是14的等电子体,O22-与F2是电子数为18的等电子体,所以E是F.
(1)N3-、O2-、F-是核外电子排布一样的离子,则核电荷数越多半径越小,故离子半径大小顺序是:N3->O2->F-,故答案为:N3->O2->F-;
(2)氟气能将氧气从其化合物中置换出来,如2F2+2H2O=4HF+O2,证明氟的非金属性强于氧,故答案为:2F2+2H2O=4HF+O2;
(3)离子化合物的构成条件:含有阴阳离子间通过静电作用形成的化学键即离子键,非金属之间形成的化学键大多是共价键,由上述元素中的4种构成的离子化合物有:NH4HCO3、(NH4)2CO3、Ca(HCO3)2、(CH3COO)2Ca,故答案为:NH4HCO3、(NH4)2CO3、Ca(HCO3)2、(CH3COO)2Ca;离子键、共价键;
(4)但其含有14电子,与N2等电子体的分子是CO,C22-中的碳原子间含有共价三键,电子式为:
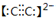
,故答案为:
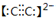
;
(5)过氧化钙和水反应生成氢氧化钙的氧气,方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑,故答案为:2CaO2+2H2O=2Ca(OH)2+O2↑.
