工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。某工厂使用还原沉淀法处理,该法的工艺流程为:
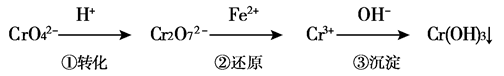
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=12,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72-的浓度不变 b.Cr2O72-和CrO42-的浓度相同
c.2v(Cr2O72-)=v(CrO42-) d.溶液的颜色不变
(3)第②步反应中,还原剂为 ,该还原剂反应后生成 。
(4)电镀废液中Cr2O72-还可通过下列反应转化:
Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+2H+(aq) ΔH< 0
2 PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是 
(1)黄色 (2)a d (3)Fe2+ Fe3+ (4)A
题目分析:(1)由2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O可在,在碱性溶液中,铬元素是以CrO42-(黄色)的形态存在于溶液中,所以若平衡体系的pH=12,则溶液显黄色;(2)Cr2O72-的浓度不变或者是溶液的颜色不变可以说明反应达到平衡,而Cr2O72-和CrO42-的浓度相同只是过程中的一个特殊时刻,不能用来判断反应是否达到平衡,2v(Cr2O72-)=v(CrO42-)也只是过程中的一个特殊时刻,不能用来判断反应是否达到平衡,故本题选择ad;(3)第②步反应中,用Fe2+作为还原剂,Fe2+被氧化为Fe3+;(4)Cr2O72-(aq)+2Pb2+(aq)+H2O(l)
Cr2O72-(橙色)+H2O可在,在碱性溶液中,铬元素是以CrO42-(黄色)的形态存在于溶液中,所以若平衡体系的pH=12,则溶液显黄色;(2)Cr2O72-的浓度不变或者是溶液的颜色不变可以说明反应达到平衡,而Cr2O72-和CrO42-的浓度相同只是过程中的一个特殊时刻,不能用来判断反应是否达到平衡,2v(Cr2O72-)=v(CrO42-)也只是过程中的一个特殊时刻,不能用来判断反应是否达到平衡,故本题选择ad;(3)第②步反应中,用Fe2+作为还原剂,Fe2+被氧化为Fe3+;(4)Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+2H+(aq) ΔH< 0,该反应为放热反应,所以温度越大,平衡常数越小,故A正确;pH越大,Cr2O72-的转化率越大,故B错误;温度升高,化学反应速率增大,所以C错误;Pb2+物质的量浓度越大,Cr2O72-物质的量浓度越小,所以D错误。
2 PbCrO4(s)+2H+(aq) ΔH< 0,该反应为放热反应,所以温度越大,平衡常数越小,故A正确;pH越大,Cr2O72-的转化率越大,故B错误;温度升高,化学反应速率增大,所以C错误;Pb2+物质的量浓度越大,Cr2O72-物质的量浓度越小,所以D错误。
点评:本题考查了化学平衡,氧化还原反应,该题有一定的综合性,但是本题难度不大。
