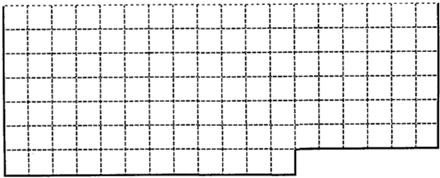
(1)上表中的实线是元素周期表部分边界,请在表中用实线画出金属元素的边界(实线内的元素全是金属元素)
(2)元素甲是第三周期ⅦA族元素,化合物A是由甲元素等非金属元素组成的离子化合物写出其化学式______,
(3)元素乙是第三周期原子半径最小的金属元素,丙是短周期元素中原子半径最大的元素,用电子式表示丙在空气中加热反应生成B的形成过程______.B中含有的化学键是______
(4)化合物C是由甲元素和乙元素形成的化合物,将化合物A与化合物C等物质的量溶于水中,向其中滴加过量的2mol•L-1氢氧化钠溶液,直至形成透明溶液.请根据实验现象出现的先后顺序,依次写出离子方程式:__________________.
(5)实验中丙元素的鉴别方法______(不写过程)与现象______.
(1)元素周期表的结构以及元素的分布情况,表示元素周期表的部分边界如下:
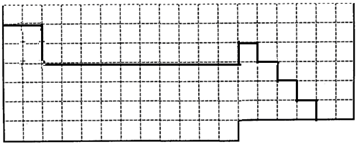
,故答案为:

;
(2)第三周期ⅦA族元素是Cl,由Cl元素等非金属元素组成的离子化合物是氯化铵,故答案为:NH4Cl;
(3)第三周期原子半径最小的金属元素为Al,短周期元素中原子半径最大的元素是Na,钠在空气中加热反应生成过氧化钠,它的形成过程可以表示为:
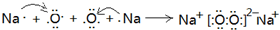
,在过氧化钠中,钠离子和过氧根之间是离子键,过氧根中氧和氧之间是共价键,故答案为:
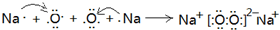
;离子键和非极性键(或离子键和共价键);
(4)化合物C是氯化铝,将化合物氯化铵与化合物氯化铝等物质的量溶于水中,向其中滴加过量的2mol•L-1氢氧化钠溶液,直至形成透明溶液铝离子先和氢氧化钠反应生成氢氧化铝沉淀,然后是铵根离子和氢氧根之间的反应,最后是氢氧化铝溶解的过程,故答案为:Al3++3OH-=Al(OH)3;NH4++OH-=NH3+H2O(NH3•H2O);Al(OH)3+OH-=AlO2-+H2O;
(5)含有钠元素的化合物的检验可以采用颜色反应的方法,颜色反应为黄色,故答案为:焰色反应;火焰呈现黄色.
