A、B、W、D、E为原子序数依次增大的五种短周期元素,已知:五种元素的原子质子数之和为39,且B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期数与主族序数相等.
(1)E元素在周期表中的位置为______周期______族.
(2)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱.请写出:A2W2的电子式______;其第一步电离的电离方程式______.工业上常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式______.
(3)由A、B两种元素形成的共价化合物甲,摩尔质量为30g/mol,在25℃,101kPa下,5克的甲气体完全燃烧,生成二氧化碳和液态水时放热 a kJ,则可表示甲的燃烧热的热化学方程式为:______.
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使其转化为氧化铜,再用硫酸溶解.现改用A2W2和稀硫酸浸泡印刷电路板达到上述目的,又保护了环境,试写出反应的离子方程式______.
A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,ⅢA族元素,故E为Al元素;A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,则:
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族.
故答案为:三,ⅢA.
(2)A2W2为H2O2,氧原子与氢原子之间形成1对共用电子对,氧原子之间形成1对共用电子对,电子式为
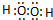
,H2O2是二元弱酸,以第一步电离为主,则电离方程式为H2O2

HO2-+H+,硫酸处理BaO2来制备H2O2,则还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2.
故答案为:
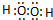
;H2O2

HO2-+H+;BaO2+H2SO4=BaSO4↓+H2O2.
(3)由A、B两种元素形成的共价化合物甲,摩尔质量为30g/mol,则甲为C2H6,5克的乙烷气体的物质的量为
=5g 30g/mol
mol,1mol乙烷完全燃烧放出的热量为6akJ,在25℃,101kPa下,甲的燃烧热的热化学方程式为:C2H6 (g)+1 6
2O2(g)=2CO2(g)+3H2O(l);△H=-6a kJ•mol-1.7 2
故答案为:C2H6 (g)+
O2(g)=2CO2(g)+3H2O(l);△H=-6a kJ•mol-1.7 2
完全燃烧,生成二氧化碳和液态水时放热 a kJ,
(4)Cu和稀硫酸不反应,加入具有氧化性的H2O2,可生成硫酸铜和水,反应的离子方程式为Cu+2H++H2O2=Cu2++2H2O.
故答案为:Cu+2H++H2O2=Cu2++2H2O.
