如图是金字塔式元素周期表的一部分(元素周期表的另一种画法),图上标有第VIA族和几种元素的位置.请回答下列问题:

(1)请在上图中描出金属与非金属的分界线,并将铁元素所在族的位置全部涂黑.
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第VIIA族,理由是:氢的最外层电子“饱和缺一”.请用电子式表示LiH:______.
(3)f与c或g均能形成一些化合物,据有关材料f与c能形成化合物fC6,f能与g形成化合物f2g.请回答下面问题:
①甲同学通过分析认为fC6此物质不可在O2中燃烧,原因是______.
②乙同学通过分析认为F2g2是分子晶体,试写出其结构简式:______;
该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液.试写出该过程的反应方程式:______.
(4)a和f形成化合物a2f,a2f分子中f原子轨道的杂化类型为______,a2f分子空间构型为______.
(5)下列叙述正确的是______
A.h的最高价氧化物对应的水化物是一种强碱.
B.硒化氢的稳定性强于f的氢化物的稳定性.
C.c与h形成化合物的水溶液显中性.
D.离子半径:f>g>h>d
E.f与d形成离子化合物为电解质,故该晶体能导电.
F.a、d、e常见氧化物熔沸点高低比较:e>d>a.
(1)金字塔式元素周期表的实质是将原周期表的空隙部分进行了删除形成的,与原元素周期表没有本质的区别,第一行为第一周期元素,第二行为第二周期元素,依此类推,同行自左而右顺序与原周期表相同.
最外层电子数小于或等于其周期数的为金属元素,据此描出金属与非金属的分界线;
铁元素在第四周期第8列,为第Ⅷ族,包括8、9、10三列.
故答案为:
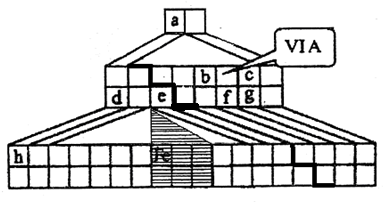
;
(2)第ⅦA族的元素的最低化合价为-1价,则LiH为离子化合物,电子式为Li+[:H]-,故答案为:Li+[:H]-;
(3)①SF6中S元素显+6价不可再升,氧气不能将-1价氟氧化,故答案为:SF6中S元素显+6价不可再升,氧气不能将-1价氟氧化;
②f2g2是S2Cl2晶体,S原子成2个共价键达8电子稳定结构,Cl原子成1个共价键达8电子稳定结构,结构式为

,
该物质遇水不稳定,生成一种黄色沉淀为S单质,生成无色气体为SO2,还得到一种酸性溶液为HCl,反应方程式为
2S2Cl2+2H2O=3S+SO2↑+4HCl,
故答案为:

;2S2Cl2+2H2O=3S+SO2↑+4HCl;
(4)a和f形成化合物H2S,S原子成2个δ键,还有2对孤对电子对,杂化轨道数=孤对电子对+δ键数=2+2=4,所以S原子采取sp3杂化,H2S分子空间构型为V型,
故答案为:sp3;V型;
(5)A.h是K元素,金属性很强,其最高价氧化物对应的水化物KOH是强碱,故A正确;
B.f是S元素,非金属性比硒强,硒化氢不如硫化氢稳定,故B错误;
C.c是F元素,h是K元素,形成的盐为强碱弱酸盐,其水溶液显碱性,故C错误;
D.f是S元素,h是K元素,d是Na元素,g是Cl元素,核外电子排布相同核电荷数越大半径越小,所以f>g>h,最外层电子数相同,电子层越大半径越大,所以h>d,所以离子半径:f>g>h>d,故D正确;
E.f是S元素,d是Na元素,二者形成化合物是离子化合物,属于电解质,晶体无自由移动的离子,不能导电,故E错误;
F.a为H元素,d是Na元素,E是Al元素,对应常见氧化物为水、氧化钠、氧化铝,分别为分子晶体、离子晶体、原子晶体,所以氧化物熔沸点水<氧化钠<氧化铝,故F正确.
故选:ADF.
