问题
问答题
下表为元素周期表的一部分.
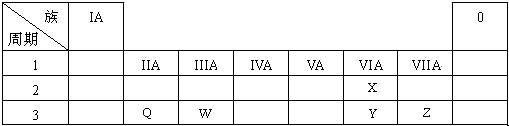
依据表中信息回答问题 (1)~(6):
(1)Q与W 金属性比较:______>______(填元素符号);
(2)离子半径比较:r(Q2+)______r(X2-)(填“>”、“=”或“<”).
(3)X与Y相应的氢化物的稳定性______>______(填化学式);
(4)用电子式表示Q与Z形成化合物的过程______;
(5)W的最高价氧化物对应水化物与氢氧化钾溶液反应的离子方程式为______;
(6)上述五种元素的最高价氧化物对应水化物中酸性最强的是______(填化学式).
答案
由元素在周期表中的位置可知,X为O,Y为S,Z为Cl,Q为Mg,W为Al,
(1)同周期,从左向右金属性减弱,所以金属性Mg>Al,故答案为:Mg;Al;
(2)Q、X的离子具有相同的电子层结构,原子序数大的离子半径小,则r(Q2+)<r(X2-),故答案为:<;
(3)非金属性X>Y,非金属性越强,气态氢化物越稳定,则稳定性H2O>H2S,故答案为:H2O;H2S;
(4)Q与Z形成化合物为氯化镁,为离子化合物,其形成过程为
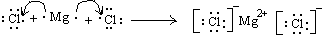
,
故答案为:

;
(5)W的最高价氧化物对应水化物为氢氧化铝,与氢氧化钾溶液反应生成偏铝酸钾和水,离子反应为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(6)上述五种元素的最高价氧化物对应水化物中酸性最强的是高氯酸,其化学式为HClO4,故答案为:HClO4.
