下表为元素周期表的一部分,参照元素①一⑧在表中的位置回答下列问题:
| 族 周期 | IA | 0 | ||||||
| l | ① | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)②、③、⑧的最高价氧化物对应水化物的酸性由强到弱的顺序是______.(用化学式表示)
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:______.
(4)由①、②、④组成的多种常见有机物中,有两种作为家庭厨房中常用调味品的主要成份,且相互可以反应生成一种具有果香味的液体,该液体也常用作香料原料.写出该反应的化学方程式:______.该反应属于______反应.
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应如图:(其中Z为白色沉淀)
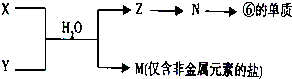
写出X溶液与Y溶液反应的离子方程式为______.
根据表知,①②③④⑤⑥⑦⑧分别是H、C、N、O、Na、Al、Si、Cl元素,
(1)原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,所以这三种元素的原子半径大小顺序是:Na>Al>O,故答案为:Na>Al>O;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,这三种元素非金属强弱顺序是Cl>N>C,所以其最高价氧化物的水化物酸性强弱顺序是:HClO4>HNO3>H2C03,故答案为:HClO4>HNO3>H2C03;
(3))①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物如氢氧化钠,其电子式为:Na+[:O:H]-,故答案为:Na+[:O:H]-;
(4)由①、②、④组成的多种常见有机物中,有两种作为家庭厨房中常用调味品的主要成份,且相互可以反应生成一种具有果香味的液体,该液体也常用作香料原料,该液体为乙酸乙酯,在一定条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,浓硫酸 △
故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O;酯化(或取代);浓硫酸 △
(5)⑥是Al,Z为白色沉淀,且含有铝元素,所以Z是Al(OH)3,N是Al2O3,M是仅含非金属元素的盐,为NH4Cl,所以M是NH4Cl,X和Y生成氢氧化铝和氯化铵,则该反应为氯化铝和氨水的反应,离子反应方程式为:A13++3NH3•H2O=A1(OH)3↓+3NH4+,故答案为:A13++3NH3•H2O=A1(OH)3↓+3NH4+.
