(1)根据氢元素最高正价与最低负价的绝对值相等,有人提议可把氢元素放在周期表中的ⅣA族.那么根据NaH的存在,又可把氢元素放在______族.
(2)某元素X的核外电子数等于核内中子数,取该元素单质2.8g与足量氧气充分反应,可得6g化合物XO2,则该元素在元素周期表中的位置是______.
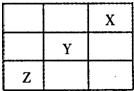
(3)短周期元素X、Y、Z在周期表中的位置关系如图所示,则:
①Y、Z元素的气态氢化物的稳定性______>______(填化学式).
②与Y元素同主族且相邻的元素的单质与NaOH溶液反应的离子方程式为______.
(1)NaH中H元素的化合价为-1价,与第ⅤⅡA元素相似,则可将H放在第ⅦA族,故答案为:ⅦA;
(2)单质2.8g与足量氧气充分反应,可得6g化合物XO2,由X+O2═XO2可知,
=2.8 M
,解得M=28,X的核外电子数等于核内中子数,则质子数为14,为Si元素,位于元素周期表中第3周期ⅣA族,故答案为:第3周期ⅣA族;6 M+32
(3)由短周期元素X、Y、Z在周期表中的位置关系,则X为He,Y为F,Z为S,
①非金属性越强,气态氢化物越稳定,非金属性F>S,则稳定性为HF>H2S,故答案为:HF;H2S;
②与Y元素同主族且相邻的元素的单质为氯气,与NaOH反应生成氯化钠、次氯酸钠和水,离子反应为Cl2+2OH-=C1-+C1O-+H2O,故答案为:Cl2+2OH-=C1-+C1O-+H2O.
