已知稀硝酸与铜反应时,NO3- 一般被还原为NO;浓硝酸与铜反应时,NO3- 一般被还原为NO2。现将25.6gCu投入到50mL12mol/L的浓硝酸中,充分反应后,收集到4.48L(标况)NO和NO2的混合气体。
(1)写出铜分别与浓硝酸和稀硝酸反应的化学方程式:______________________________________________________________;
_______________________________________________________________。
(2)被还原的硝酸的物质的量为:____________
(3)25.6gCu与50mL12mol/L的浓硝酸反应后,剩余物为:____________,其物质的量为:____________。
(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3 Cu(NO3)2+2NO↑+4H2O
(2)0.2mol (3)铜; 0.2mol
题目分析:(1)硝酸具有强氧化性,和金属铜反应的化学方程式分别是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3 Cu(NO3)2+2NO↑+4H2O。
(2)硝酸被还原生成NO或NO2,所以被还原的硝酸的物质的量就是生成的混合气的物质的量,即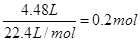 。
。
(3)根据(2)可知,没有被还原的硝酸的物质的量是
0.05L×12mol/L-0.2mol=0.4mol
25.6g铜的物质的量是25.6g÷64g/mol=0.4mol
如果铜完全反应则应该生成0.4mol硝酸铜
则没有被还原的硝酸的物质的量就是0.8mol>0.4mol
这说明反应中硝酸是不足的,铜过量
应该生成硝酸铜的物质的量是0.4mol÷2-0.2mol=0.2mol
所以过量的铜的物质的量是0.4mol-0.2mol=0.2mol
点评:该题是属于中等难度的计算题,本题的关键是学会利用好各种守恒法解题,化学计算中常用的守恒法包括质量守恒定律、原子守恒、电子的得失守恒以及电荷守恒等,需要学生在平时的训练注意总结、归纳和积累。
