下图是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)①②③三种元素的气态氢化物的稳定性由强到弱的顺序是______(用相应氢化物的化学式作答).元素①~⑧中的最高价氧化物对应的水化物中呈两性的氢氧化物是______(填化学式),它与元素④的最高价氧化物对应的水化物的溶液反应的离子方程式是______.
(3)某同学设计并进行实验,探究元素④⑤⑥金属性递变规律,请将实验报告补充完全.
| 实验步骤 | 实验现象 |
| 1.将一小块④的单质放入滴有酚酞溶液的冷水中 | ______,发出嘶嘶响声,逐渐消失,溶液变成红色 |
| 2.将少量冷水注入盛有打磨过的⑤的单质的试管中,再滴加酚酞,一段时间后加热至沸腾 | 加热后______ |
| 3.将2mL1mol/L盐酸加入盛有打磨过的⑤的单质的试管中 | 剧烈反应,迅速产生大量无色气泡 |
| 4.将2mL1mol/L盐酸加入盛有打磨过的______的单质的试管中 | 反应缓慢,一段时间后,产生无色气泡 |
| 结论:______(用元素符号结合文字说明) | |
由元素在周期表中的位置可知,①为C,②为N,③为F,④为Na,⑤为Mg,⑥为Al,⑦为Cl,⑧为Ar,
(1)Ar的化学性质最不活泼元素,原子结构示意图为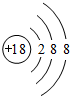 ;
;
原子半径增大的元素处于第三周期ⅠA族,为Na;
HCl中氢原子与氯原子之间形成1对共用电子对,电子式为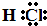 ,
,
故答案为: ;Na;
;Na;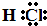 ;
;
(2)非金属性F>N>C,故氢化物稳定性HF>NH3>CH4,Al(OH)3是两性氢氧化物;氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:HF>NH3>CH4;Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(3)1.钠与水反应生成氢氧化钠与氢气,钠的密度小于水,熔点较低,钠浮在水面上,熔成小球,四处游动,发出嘶嘶响声,逐渐消失,溶液变成红色;
2.镁和滴有酚酞的沸水反应生成氢氧化镁和氢气,氢氧化镁在水中能电离出氢氧根离子使溶液呈碱性,但氢氧化镁的溶解性很小,溶液呈浅红色;
4.实验探究元素④⑤⑥金属性递变规律,故应是Al与盐酸反应;
由金属与、水及酸的反应剧烈程度可知,Na、Mg、Al三种元素的金属性依次减弱,
故答案为:
| 实验步骤 | 实验现象 |
| 1.将一小块④的单质放入滴有酚酞溶液的冷水中 | 钠浮在水面上,熔成小球,四处游动,发出嘶嘶响声,逐渐消失,溶液变成红色 |
| 2.将少量冷水注入盛有打磨过的⑤的单质的试管中,再滴加酚酞,一段时间后加热至沸腾 | 加热后 镁条表面产生无色气泡,溶液呈红色 |
| 3.将2mL1mol/L盐酸加入盛有打磨过的⑤的单质的试管中 | 剧烈反应,迅速产生大量无色气泡 |
| 4.将2mL1mol/L盐酸加入盛有打磨过的 Al的单质的试管中 | 反应缓慢,一段时间后,产生无色气泡 |
| 结论:Na、Mg、Al三种元素的金属性依次减弱 | |
