如图为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
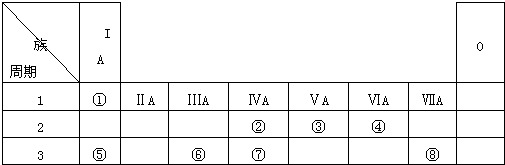
(1)④、⑤、⑥的原子半径由大到小的顺序为______.
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______;②、③、⑦的气态氢化物的稳定性由强到弱的顺序是______.
(3)①、④、⑤、⑧中的某三种元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的化学式:______.
(4)写出⑤的最高价氧化物对应的水化物与⑥的最高价氧化物反应的离子方程式:______
(5)③的最高价氧化物对应的水化物与其气态氢化物反应的离子方程式为______
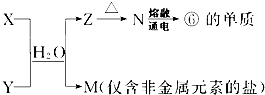
(6)由表中①、③、④、⑥、⑧元素形成的常见物质X、Y、Z、M、N可发生以下反应:X溶液与Y溶液反应的离子方程式为______,N→⑥的单质的化学方程式为______.
由元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl,
(1)同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Al>O,故答案为:Na>Al>O;
(2)②、③、⑦对应的元素分别为C、N、Si,非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强、氢化物越稳定,则酸性为HNO3>H2CO3>H2SiO3,氢化物稳定性NH3>CH4>SiH4,
故答案为:O<Al<Na;HNO3>H2CO3>H2SiO3;NH3>CH4>SiH4;
(3)①、④、⑤、⑧中的某三种元素可形成既含离子键又含极性共价键的化合物,为NaOH或NaClO等,故答案为:NaOH或NaClO等;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(5)硝酸与氨气反应生成硝酸铵,反应离子方程式为:NH3+H+═NH4+,故答案为:NH3+H+═NH4+;
(6)⑥为Al元素,由转化关系可知N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,反应离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,N→⑥的单质的化学方程式为:2Al2O3(熔融)
4Al+3O2↑,通电 .
故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;2Al2O3(熔融)
4Al+3O2↑.通电 .
