(1)写出硫酸铁在水溶液中电离的电离方程式
(2)用双线桥法,标出下列氧化还原反应的电子转移方向和电子总数
2FeCl3+Fe=3FeCl2 氧化剂是 (填化学式)
(3)氨的催化氧化是工业上制硝酸的基础:4NH3 + 5 O2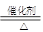 4NO + 6H2O ,其中作为还原剂的物质是 (填化学式);若反应中生成了0.2 mol NO,则转移 mol电子,
4NO + 6H2O ,其中作为还原剂的物质是 (填化学式);若反应中生成了0.2 mol NO,则转移 mol电子,
(4)在一定条件下,RO3n-和氯气可发生如下反应: RO3n- + Cl2 + 2OH- = RO42- + 2Cl- +H2O由以上反应可知在上过程中RO3n-被 (填“氧化”或“还原”), RO3n-中元素R的化合价是 。
17.(1)Fe2(SO4)3=2Fe3+ +2SO42-(2分)(2)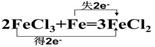 ; FeCl3
; FeCl3
(3) NH3; 0.25 (4)氧化; +4 。其它每空1分
题目分析:(2)氯化铁中的铁从三价降低到二价,故得到了一个电子,发生还原反应,做氧化剂,即2个氯化铁就得到2个电子;铁中铁从零价升高到二价,故失去了2个电子,发生氧化反应,做还原剂。
(3)NH3中的N从-3价升高到+2价,发生氧化反应,做还原剂,O2中的O从0价降低到-2价,发生还原反应,做氧化剂。
4NH4- 4NO- 5e-
0.2mol x x=0.25mol
(4)由电荷守恒可知n=2,则RO32-中的R由+4价升高到+6价,发生了氧化反应。
点评:此题考核了氧化还原反应中氧化剂还原剂的判断,难度不大。