问题
问答题
有一包白色固体粉末,可能含有CuSO4、Na2SO4、(NH4)2CO3、BaCl2、NH4Cl、KCl中的一种或几种.现做如下实验:
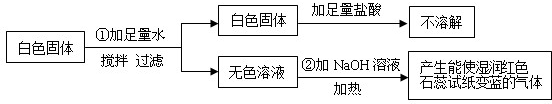
根据上述实验现象判断:
(1)白色固体中一定不含______,一定含有______,可能含有______.
(2)写出①中化学反应方程式______.
(3)写出②中化学反应方程式______.
答案
(1)由步骤①可知,白色固体中一定没有硫酸铜,因为硫酸铜溶于水呈蓝色;过滤得到的白色固体加入足量的盐酸不溶解,因此白色固体中一定没有碳酸铵,此白色固体是硫酸钡,说明原混合物中一定有Na2SO4、BaCl2;由步骤②可知,加入氢氧化钠溶液加热,产生了能使湿润的红色石蕊试纸变蓝的气体,此气体是氨气,因此原白色固体中一定含有氯化铵;KCl可能有也可能没有;故答案为:CuSO4、(NH4)2CO3; Na2SO4、BaCl2、NH4Cl; KCl
(2)硫酸钠和氯化钡反应生成硫酸钡白色沉淀和氯化钠,配平即可,故答案为:Na2SO4+BaCl2=BaSO4↓+2NaCl
(3)氢氧化钠和氯化铵在加热的条件下反应生成氯化钠和水和二氧化碳,故答案为:NaOH+NH4Cl
NaCl+NH3↑+H2O △ .
