将128 g铜置入一定量的浓硝酸中,并微热,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当铜反应完毕时(铜片完全消失),共收集到NO2和NO的混合气体44.8 L气体(标准状况),求:
(1)写出上述过程中,有关反应的化学方程式___________、_________________。
(2)完成该反应至少需要量取10 mol/L的浓硝酸_________mL。
(3)混合气体中NO2的体积为 、NO的体积为 。
(1)Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O
(2)600 mL
(3)V(NO2)= 22.4L V(NO)=" 22.4L"
题目分析:(1) Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O
注意方程式的配平,气体箭头符号。
(2)2Cu+6HNO3=2Cu(NO3)2+NO2↑+NO↑+3H2O
根据化学方程式,128 g铜即2molCu,可算出需要10 mol/L的浓硝酸: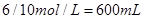
(3) NO2和NO的混合气体44.8 L(标准状况),,即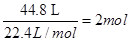 ,即
,即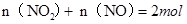 ①
①
而128g铜失去电子: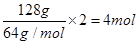 ,则
,则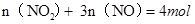 ②,由①②可解出
②,由①②可解出 ,
,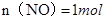 ,即
,即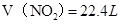 ,
, 。
。
点评:本题综合性较强,考查了铜与浓硝酸、稀硝酸反应的知识点,历年高考常考,计算时应抓住得失电子守恒,化繁为简。
