s国钾长石(KAlSi3O8)的资源比较丰富.一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)⇌KCl(l)+NaAlSi3O8(s).
(1)1述反应涉及的第三周期元素中,离子半径最小的是______(用元素符号表示).Cl原子与Si原子可以形成的五核分子,其化学键键长和键角都相等,则该物质为______分子(填“极性”或“非极性”),该分子的电子式为______.
(2)不能用于比较Na与Al金属性相对强弱的事实是______.
A.最高价氧化物对应水化物的碱性B.Na和Al的熔点高低
C.单质与H2O反应的难易程度D.比较同浓度NaCl和AlCl3的pH值
(3)1述元素的最高价氧化物对应水化物中,有一种既能与强酸又能与强碱反应,其原因在于:______(用电离方程式表示).
(4)钾长石和烧碱在熔融状态下反应可得到两种正盐,向所得的正盐中加入过量稀盐酸,发生反应的离子方程式分别是:______、______.
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______.
(6)为研究1述反应中钾元素的熔出率(液体中钾元素的质量占全部钾元素质量的百分率)与温度的关系,进行实验(氯化钠与钾长石投料的质量比为2:1),获得如下数据:
时间(h) 钾元素 温度熔出率 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890℃ | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950℃ | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
②计算890℃时,氯化钠的平衡转化率______(式量:KAlSi3O8-278NaAlSi3O8-262,保留3位小数).
(0)涉及短周期元素有Na、Al、Si、Cl,阴离子有5左电子层,阳离子有2左电子层,原子序数大的离子半径小,则离子半径最小的为Al,Cl原子与Si原子可以形成的1核分子,其化学键长和键角都相等,分子为正四面体结构,为非极性分子,其电子式为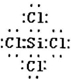 ,
,
故答案为:Al;非极性; ;
;
(2)比较金属性强弱,可根据对应的最高价氧化物的水化物的碱性、金属与酸、水反应的剧烈程度等角度,而熔点与金属性无关,不能用于比较金属性强弱,
故答案为:B;
(5)能与强酸又能与强碱反应为氢氧化铝,为两性氢氧化物,可发生酸式电离和碱式电离,为H++AlO2-+H2O⇌Al(OH)5⇌Al5++5OH-,
故答案为:H++AlO2-+H2O⇌Al(OH)5⇌Al5++5OH-;
(4)钾长石和烧碱在熔融状态下反应可得到两种正盐,为偏铝酸盐和硅酸盐,均与盐酸反应,离子反应分别为4H++AlO2-=Al5++2H2O、2H++SiO52-=H2SiO5↓,
故答案为:4H++AlO2-=Al5++2H2O;2H++SiO52-=H2SiO5↓;
(5)SiO和NaOH溶液反应生成硅酸钠和氢气,该反应为SiO+2NaOH=Na2SiO5+H2↑,故答案为:SiO+2NaOH=Na2SiO5+H2↑;
(6))①由表中数据可知,温度越高钾元素的熔出率,说明升高温度,平衡向正反应方向移动,则正反应为吸热反应,故答案为:吸热;
②890℃时,当浸出率为5.5时,该反应达到平衡状态,氯化钠与钾长石投料的质量比为2:0,设钾长石的质量为278g,其物质的量为0mol,则氯化钠的质量为556g,当平衡时,钾元素的熔出率为0.669,则钾长石反应的物质的量为0.669mol,
根据NaCl(l)----KAlSi5O8知,氯化钠反应的物质的量也是0.669mol,其转化率为
=0.074(或7.4%),故答案为:0.074(或7.4%).0.699mol×58.5g/mol 556g
