研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1) NO2可用水吸收,相应的化学反应方程式为__________________,
利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-1
2NO(g)+O2(g) = 2NO2(g) △H=-113.0 kJ·mol-1
则反应SO2(g)+NO2(g) = SO3(g)+ NO(g)的△H=________ kJ·mol-1 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO2和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)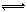 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
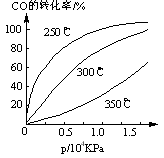
(1)3NO2+H2O = 2HNO3+NO;6.72
(2)-41.8;B;2.67或8/3
(3)<;在1.3×104Kpa下,CO转化率已较高,再增大压强CO转化率提高不大,而生产成本增加,故得不偿失。
