稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解。
(1)无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________。
(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
___Ce3++ ___H2O2+ ___H2O → ___Ce(OH)4↓+ ______
(3)在溶液中,反应A+2B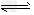 C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为
 、
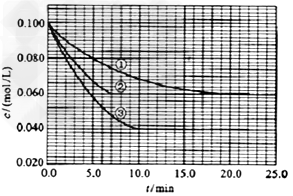
、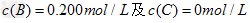 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②______________;③_______________; 实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;该反应是________热反应,判断其理由是____________________________;该反应进行到4.0min时的平均反应速度率:实验②: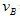 =__________________________________;
=__________________________________;
(1)分解出HCl气体,抑制CeCl3的水解
(2)2Ce3++H2O2+6H2O→ 2Ce(OH)4↓+6H+
(3 )②加催化剂,达到平衡的时间缩短,平衡时A的浓度未变;③温度升高,达到平衡的时间缩短,平衡时A的浓度减小;40%(或0.4);0.06mol/L; 吸热;升高温度平衡向正反应方向移动,故该反应是吸热反应;0.014mol(L·min)-1
