(1)在试管里放入一小块铜片,注入一定体积的浓硫酸,给试管加热,使之反应。若铜片还有剩余硫酸是否消耗完毕?
①结论及理由是:_________________________________________。
②向100毫升18 mol/L的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量
A.小于0·9 mol B.等于0·9 mol C.在0·9 mol与1.8 mol之间 D.大于1·8 mol
③50g的胆矾加热到100℃失去部分结晶水后,质量变为35.6g,则失去水后的硫酸铜晶体的化学式是
A.CuSO4·H2O B.CuSO4·2H2O C.CuSO4·3H2O D.CuSO4
(2)足量的锌投入到一定量的浓硫酸中,充分反应后共收集到SO2和H222.4L(标准状况)。
①简述能产生H2的原因是____________ __________________
②上述变化中体现浓硫酸强氧化性的反应方程式是:
③反应共消耗金属锌的质量为_________g。
④以上数据能否计算出消耗的硫酸的物质的量? _ (填“能”或“不能”)
(12分)(1)①否,随反应进行,硫酸浓度不断降低,稀硫酸与铜不反应,所以硫酸会有剩余 ②A ③A
(2)①随反应的不断进行,浓硫酸浓度不断降低,与锌稀硫酸反应产生了氢气
②Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O ③65 ④不能
题目分析:(1)①由于随反应进行,硫酸浓度不断降低,稀硫酸与铜不反应,所以硫酸会有剩余。
②浓硫酸的物质的量是1.8mol,所以根据反应式Cu+2H2SO4(浓)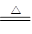 CuSO4+2H2O+SO2↑,并结合①可知,实际被还原硫酸的物质的量小于0.9mol,答案选A。
CuSO4+2H2O+SO2↑,并结合①可知,实际被还原硫酸的物质的量小于0.9mol,答案选A。
③50g的胆矾加热到100℃失去部分结晶水后,质量变为35.6g,则失去的水的质量是50g-35.6g=14.4g,物质的量是0.8mol。胆矾的物质的量是0.2mol,共计含有1mol水。这说明反应后含有的水的物质的量水0.2mol,所以化合物的化学式是CuSO4·H2O,答案选A。
(2)①由于随反应的不断进行,浓硫酸浓度不断降低,与锌稀硫酸反应产生了氢气。
②体现浓硫酸强氧化性的反应方程式是Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O。
③混合气的物质的量是1mol,由于不论是氢气,还是SO2,在反应中都是转移2个电子的,所以共计电子得失守恒可知,参加反应的锌的物质的量也是1mol,质量是65g。
④由于不能确定SO2的物质的量,所以无法确定消耗的硫酸的物质的量。
点评:该题是高考中的常见题型,试题综合性强,难易适中。该题在注重对基础性知识考查与训练的同时,主要是侧重培养学生的解题方法与技巧,有利于调动学生的学习兴趣,激发学生的求知欲。该题的关键是理解浓硫酸的化学性质,以及利用好守恒法在化学计算中的重要应用。
