问题
问答题
实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式如下:
MnO2+4HCl=MnCl2+Cl2↑+2H2O
(1)该反应属于氧化还原吗?如果是,指出其中的氧化剂和还原剂;如果不是,说明理由。
(2)密度为1.19g·cm-3、溶质的质量分数为36.5%的浓盐酸200mL,跟足量二氧化锰发生反应,产生的氯气在标准状况下的体积为11.2L。计算参加反应的浓盐酸的体积以及反应中被氧化的HCl的物质的量。
答案
(1)属于(1分),氧化剂:MnO2(1分);还原剂:HCl(1分)
(2)被氧化的HCl的物质的量为1 mol(3分),体积为168mL(3分)
题目分析:(1)该反应属于氧化还原,其中MnO2作氧化剂,锰元素由+4价变MnCl2的+2价,HCl作还原剂,氯元素由-1价变成Cl2的0价。(2)产生的氯气在标况下体积11.2L,即0.5mol,则被氧化的HCl的物质的量为0.5mol×2=1mol;参加反应的浓盐酸的物质的量为0.5mol×4=2mol,根据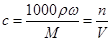 ,带入数据可得出V="168" mL。
,带入数据可得出V="168" mL。
点评:本题考查氧化还原反应的应用,较为基础。




