问题
填空题
下列两个反应均为在溶液中进行的反应,试按下列要求作答:
①在表格中填出反应式中的氧化剂、还原剂,氧化产物、还原产物。
②将其改写成离子方程式;
(1) 2FeCl3 + H2S =2FeCl2 + S↓ + 2HCl
| 氧化剂: | 还原剂: | ||
| 氧化产物: | 还原产物: |
(2)MnO2 + 4HCl(浓) 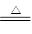 MnCl2 + 2H2O + Cl2↑
MnCl2 + 2H2O + Cl2↑
| 氧化剂: | 还原剂: | ||
| 氧化产物: | 还原产物: |
答案
(12分,离子方程式2分,其余每空1分)
(1)FeCl3;H2S ;S ;FeCl2;2Fe3++ H2S= 2Fe2++ S↓ + 2H+
(2)MnO2;HCl ;Cl2;MnCl2;MnO2 + 4H++2Cl-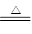 Mn2+ + 2H2O + Cl2↑
Mn2+ + 2H2O + Cl2↑
题目分析:(1)根据反应的化学方程式可知,氯化铁中铁元素的化合价从+3价降低到+2价,得到1个电子,氯化铁是氧化剂,氯化亚铁是还原产物;H2S中S元素的化合价从-2价升高到0价,失去2个电子,H2S是还原剂,单质S是氧化产物,该题反应的离子方程式是2Fe3++ H2S= 2Fe2++ S↓ + 2H+。
(2)二氧化锰中Mn元素的化合价从+4价降低到+2价,得到2个电子,二氧化锰是氧化剂,氯化锰是还原产物;氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子,氯化氢是还原剂,氯气是氧化产物,该反应的离子方程式是MnO2 + 4H++2Cl-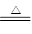 Mn2+ + 2H2O + Cl2↑。
Mn2+ + 2H2O + Cl2↑。
点评:该题是中等难度的试题,试题基础性强,注重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑思维能力,提高学生分析问题、解决问题的能力。该题的关键字准确标出有关元素的化合价变化情况,然后依据有关的概念灵活运用即可。
