阅读理解
Communicating with Gestures
When travelling, you may think that if you don't know the language, you can communicate using
gestures. However, very few gestures are universally understood and interpreted. What is perfectly
acceptable in this country may be rude in other cultures.
1. Pointing at something using the index finger. It is impolite to point with the index finger in the
Middle and Far East. Use an open hand or your thumb in Indonesia.
2. Making a "V"sign. This means "victory"in most parts of Europe when you make the sign with
your palm facing away from you. But if you face your palm in, the gesture is very rude.
3. Smiling. This facial expression is universally understood. However, cultures can provide different
reasons for smiling. The Japanese may smile when they are confused or angry while in other parts of
Asia people smile when they are embarrassed. People in some cultures only smile to friends. It is
important not to judge people for not smiling, or for smiling at what we would consider "inappropriate"
times.
4. Waving one's hand with the palm facing outward to greet someone. In parts of Europe, waving the
hand back and forth can mean "No". To wave "goodbye", raise the palm outward and wave the fingers
together; but this is rude in Nigeria if the hand is too close to another person's face.
5. Forming a circle with one's fingers to mean "OK". Although this means "OK"in the U. S. and many
other countries, there are some notable exceptions. In Brazil and Germany the gesture is obscene
(猥亵的), while in Japan it means"money". In France, it has the additional meaning of "zero"or
"worthless".
1. According to the text, when we travel to other countries________.
A. many gestures are universally recognized
B. the same gesture can have different meanings
C. a smile always suggests friendliness
D. we can still communicate without knowing the languages
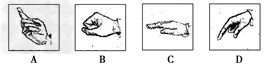
2. Which of the following gestures should be used to point at an object in Indonesia?
3. What does the word "inappropriate"in Paragraph 4 probably mean?
A. Unsuitable.
B. Impolite.
C. Uncomfortable.
D. Ordinary.
4. When you talk to people from Brazil, you should remember not to ________.
A. smile at them
B. make a "V"sign
C. point at objects around you
D. make the "OK"gesture
5. The text is mainly to __________.
A. show that gestures are universally accepted
B. warn readers of impolite gestures
C. show the different meanings of gestures in different countries
D. teach readers how to understand gestures in other countries
 7N2+12H2O也可处理NO2。当转移12mol电子时,消耗的NO2在标准状况下是_________L。
7N2+12H2O也可处理NO2。当转移12mol电子时,消耗的NO2在标准状况下是_________L。 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol  2NO2(g) ΔH=-113.0 kJ/mol
2NO2(g) ΔH=-113.0 kJ/mol  SO3(g)+NO(g)的ΔH=____________kJ/mol。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。
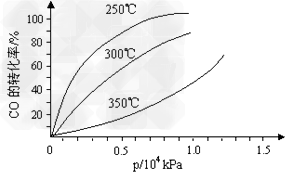
SO3(g)+NO(g)的ΔH=____________kJ/mol。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。  CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是__________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是__________________。