SO2随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法。
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下
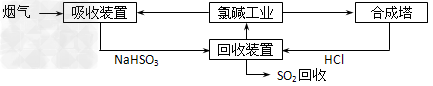
①“吸收装置”中发生反应的离子方程式是____________________;
②上述流程中循环利用的一种物质是__________________。
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2。
① 该反应的离子方程式是___________________(反应a)。为验证该反应,同学们将SO2通入0.05 mol·L-1 FeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色。关于红褐色液体,以下是同学们的分析推测与实验。

② 利用胶体的__________(填性质)可以检验步骤ⅰ中是否得到了Fe(OH)3胶体;
③ 根据反应b,说明步骤ⅱ中液体颜色变化的原因是_____________________(用离子方程式及必要的文字说明)。
④ 经讨论后得出结论:FeCl3溶液和SO2反应过程中,反应a、b在体系中共存。原因是由于化学反应速率:b>a,化学反应限度:a>b,所以产生上述现象。
(1)① SO2+OH-=HSO3-;②NaCl溶液
(2)① 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ ;② 丁达尔效应;③ 加入铁粉时发生反应2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应b逆向移动
