高锰酸钾(KMnO4)是一种常用的氧化剂。
I.(1)有下列变化: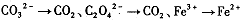 ,找出其中一个变化与“
,找出其中一个变化与“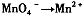 ”组成一个反应,写出该反应的离子方程式____ 。
”组成一个反应,写出该反应的离子方程式____ 。
(2)不同条件下高锰酸钾可发生如下反应: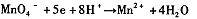
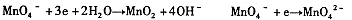 由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。
由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。
(3)高锰酸钾溶液与硫化亚铁有如下反应:
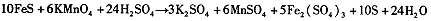
若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为 个。
Ⅱ.酒后驾车已成为一个社会问题。检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种。
(4)早期是利用检测试剂颜色变化定性判断BrAC,曾用如下反应检测BrAC:
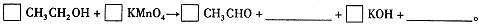
完成并配平上述反应。
(5)受上述方法启发,后来用五氧化二碘的淀粉溶液检测BrAC,乙醇被氧化为乙醛,该反应的化学方程式为____ 。
14分
⑴2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O (3分)
⑵溶液酸碱性 (2分)
⑶0.1NA (6.02×1022) (3分)
⑷3CH3CH2OH+2KMnO4=3CH3CHO+2MnO2+2KOH+2H2O (3分)
⑸I2O5+5 CH3CH2OH→I2+5CH3CHO+5H2O (3分)
题目分析:⑴“MnO4-→Mn2+”是还原,那么另一过程必定是氧化,故只有“C2O42-→CO2”合题意,方程式为2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O。
⑵由条件中的三个半反应可知是溶液酸碱性。
⑶由化学方程式可得关系式:10FeS ~ 10S ~ Δm(固)~ 转移e-
880g 320g 560g 20mol
2.8g ∴0.1mol
转移电子数目为0.1NA (或6.02×1022)。
⑷由于反应生成了碱,根据第⑵题可知KMnO4被还原为MnO2,故方程式为:
3CH3CH2OH+2KMnO4=3CH3CHO+2MnO2+2KOH+2H2O
⑸用五氧化二碘的淀粉溶液检测BrAC,乙醇被氧化为乙醛,那么I2O5就被还原为I2。
I2O5+5 CH3CH2OH→I2+5CH3CHO+5H2O
