某一反应体系中共有Pb3O4、NO、MnO2、Cr2O3、Cr(MnO4)2和Pb(N3)2(名称叠氮化铅,其中Pb为+2价)六种物质,已知Pb(N3)2是反应物之一,Cr2O3是产物之一。请回答下列问题:
(1)已知Cr的常见化合价为+2、+3、+6,Mn的常见化合价为+2、+4、+6、+7,则Cr(MnO4)2中Cr的化合价为 。
(2)1mol Pb(N3)2在反应中 (填“得到”或“失去”) mol电子。
(3)写出该反应的化学方程式 。
(8分,每空2分)
(1)+2 (2)失去 44/3或14.6
(3)15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO↑+88MnO2+22Cr2O3
题目分析:Pb(N3)2是反应物之一,Pb3O4、NO肯定是产物,Pb(N3)2是不原剂,另一反应物中元素化合价要降低,Cr(MnO4)2是氧化剂,MnO2是还原产物。
(1)Cr(MnO4)2中Cr的化合价由化学式可知,肯定是偶数,由化合价代数和等于0,Mn为+7价时,Cr为+2价,合理;Mn为+6价时,Cr为+4价,不合理;答案:+2;⑵Pb(N3)2中Pb由+2价升高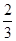 价,变成
价,变成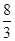 ,N由-
,N由-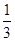 升高
升高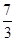 变成+2价,1mol Pb(N3)2在反应中共失去
变成+2价,1mol Pb(N3)2在反应中共失去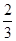 +6×
+6×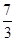 =
= ,答案:失去 44/3或14.6;⑶1mol Pb(N3)2在反应中共失去
,答案:失去 44/3或14.6;⑶1mol Pb(N3)2在反应中共失去 mol电子,1molCr(MnO4)2得到6mol电子,失去1mol电子,净得5mol电子,由得失电子守恒可配平方程式:Pb(N3)2前配15,Cr(MnO4)2前配44,再根据质量守恒,不难将方程式配平,15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO↑+88MnO2+22Cr2O3,答案:15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO↑+88MnO2+22Cr2O3。
mol电子,1molCr(MnO4)2得到6mol电子,失去1mol电子,净得5mol电子,由得失电子守恒可配平方程式:Pb(N3)2前配15,Cr(MnO4)2前配44,再根据质量守恒,不难将方程式配平,15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO↑+88MnO2+22Cr2O3,答案:15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO↑+88MnO2+22Cr2O3。
