2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物
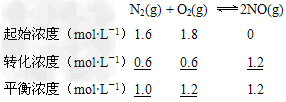
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,该反应的速率
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,该反应的速率 (NO)为________;计算该条件下的平衡常数(写出计算过程)。
(NO)为________;计算该条件下的平衡常数(写出计算过程)。
(2)恒温恒容,能说明反应 2NO(g) N2(g)+O2(g) 达到平衡的是__________(填代号)。
N2(g)+O2(g) 达到平衡的是__________(填代号)。
A.单位时间内消耗2 mol NO,同时消耗1 mol N2
B.NO、N2、O2的浓度之比为2:1:1
C.N2的浓度不再发生变化
D.容器内气体密度不再发生变化
(3)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:
N2(g)+ O2(g) = 2NO(g) △H = +180.5kJ/mol
2H2(g)+ O2(g) = 2H2O(l) △H = -571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为_________________。
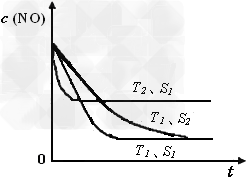
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图是反应:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H________0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在下图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H________0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在下图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
(1)0.24mol/(L·min) ;

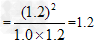
(2)AC
(3)①2H2(g)+ 2NO(g)= N2(g)+2H2O(l) △H = -752.1kJ/mol
②<;