(10分)浓盐酸与重铬酸钾[K2Cr2O7(s)]共热时产生某种气体单质X,产物中还有三氯化铬等生成。这种方法制X时便于控制反应,撤去酒精灯则反应停止。现在要制得纯净的X(装置如图)。
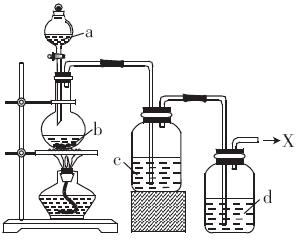
(1)加热时,a与b反应的化学方程式__________________________________
(2)液体C的作用是_____________________________________________
现在把制得的纯净干燥的X通入下图所示的装置。
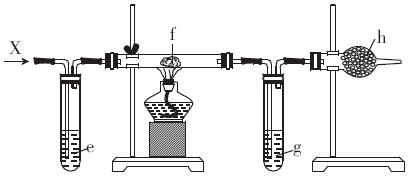
(3)e是FeBr2溶液,一段时间后观察到的实验现X象是________________________________
(4)f是浸有一种钾盐溶液的棉球,一段时同后观察到试管内有紫色气体,则大试管内发生反应的化学方程式为________________________
(5)g是水和CCl4的混合物,可看到颜色较深的液体在____ (填“上”或“下”)层.
(6)h是碱石灰,则此装置的作用是______________________________________________
(1)14HCl(浓)+K2Cr2O7 2KCl+2CrCl3+3Cl2↑+7H2O(3分)
2KCl+2CrCl3+3Cl2↑+7H2O(3分)
(2)除HCl(1分)
(3)溶液由浅绿色变成黄色,再变成棕黄色(2分)
(4) Cl2+2KI=I2+2KCl(2分)
(5)下(1分)
(6)吸收多余的Cl2(1分)
本题由信息可以知道加热时,a与b反应的化学方程式14HCl(浓)+K2Cr2O7 2KCl+2CrCl3+3Cl2↑+7H2O,要得到纯净干燥的Cl2先除去HCl和H20,所以C为饱和食盐水除去HCl,D为浓硫酸除去H20。Cl2有强氧化性,和FeBr2反应,反应先后规律:当有多种氧化剂、多种还原剂时,氧化性越强的氧化剂、还原性越强的还原剂越先反应。如:FeBr2和Cl2反应时,由于Fe2+离子的还原性比Br-离子的还原性强,所以Cl2先氧化Fe2+离子,Cl2过量时再氧化Br-离子。因此, FeBr2和少量Cl2反应时,离子方程式是:2 Fe2++ Cl2="2" Fe3++2Cl-; FeBr2和过量Cl2反应时,离子方程式是:2Fe2++4Br-+3Cl2-=2Fe3++2Br2+6Cl-。现象为溶液由浅绿色变成黄色,再变成棕黄色。由f是浸有一种钾盐溶液的棉球,一段时同后观察到试管内有紫色气体,马上就确定Cl2+2KI=I2+2KCl。g是水和CCl4的混合物,I2在里面分层,CCl4比水的密度大,在下层。h是碱石灰吸收多余的Cl2。
2KCl+2CrCl3+3Cl2↑+7H2O,要得到纯净干燥的Cl2先除去HCl和H20,所以C为饱和食盐水除去HCl,D为浓硫酸除去H20。Cl2有强氧化性,和FeBr2反应,反应先后规律:当有多种氧化剂、多种还原剂时,氧化性越强的氧化剂、还原性越强的还原剂越先反应。如:FeBr2和Cl2反应时,由于Fe2+离子的还原性比Br-离子的还原性强,所以Cl2先氧化Fe2+离子,Cl2过量时再氧化Br-离子。因此, FeBr2和少量Cl2反应时,离子方程式是:2 Fe2++ Cl2="2" Fe3++2Cl-; FeBr2和过量Cl2反应时,离子方程式是:2Fe2++4Br-+3Cl2-=2Fe3++2Br2+6Cl-。现象为溶液由浅绿色变成黄色,再变成棕黄色。由f是浸有一种钾盐溶液的棉球,一段时同后观察到试管内有紫色气体,马上就确定Cl2+2KI=I2+2KCl。g是水和CCl4的混合物,I2在里面分层,CCl4比水的密度大,在下层。h是碱石灰吸收多余的Cl2。
