已知某温度下,无水Na2CO3的溶解度是10.0 g/(100 g水)。在该温度下,向足量的饱和Na2CO3(aq)中加入1.06 g无水Na2CO3,搅拌后静置。试求最终所得晶体的质量。
3.45 g
解答本题有两种方法,一是过程思维法,二是终态思维法。
方法1(过程思维法):先求加入的1.06 g无水Na2CO3形成并析出晶体的质量m1(Na2CO3·10H2O)及溶液中由此减少的水的质量m1(H2O)
Na2CO3 ~ Na2CO3·10H2O ~ 10H2O
106 g 286 g 180 g
1.06 g m1(Na2CO3·10H2O) m1(H2O)
m1(Na2CO3·10H2O)="2.86" g m1(H2O)="1.80" g
再求溶解在1.80 g水中Na2CO3的质量m2(Na2CO3),及这些Na2CO3析出所形成晶体的质量m2(Na2CO3·10H2O)和溶液由此而减少水的质量m2(H2O)
m2(Na2CO3)=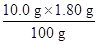 =0.180 g
=0.180 g
Na2CO3 ~ Na2CO3·10H2O ~ 10H2O
106 g 286 g 180 g
0.180 g m2(Na2CO3·10H2O) m2(H2O)
m2(Na2CO3·10H2O)="0.486" g m2(H2O)="0.306" g
依次类推,求m3(Na2CO3)及m3(Na2CO3·10H2O)和m3(H2O),直至所得晶体质量mi(Na2CO3·10H2O)在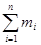 (Na2CO3·10H2O)的和中可以忽略为止。
(Na2CO3·10H2O)的和中可以忽略为止。
m3(Na2CO3)=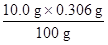 =0.0306 g
=0.0306 g
Na2CO3 ~ Na2CO3·10H2O ~ 10H2O
106 g 286 g 180 g
0.0306 g m3(Na2CO3·10H2O) m3(H2O)
m3(Na2CO3·10H2O)="0.0826" g m3(H2O)="0.0520" g
m4(Na2CO3)=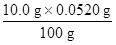 ="0.00520" g
="0.00520" g
m4(Na2CO3·10H2O)=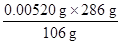 ="0.0140" g
="0.0140" g
……(生成固体质量以0.170倍递减)
最后得出所得晶体质量m(Na2CO3·10H2O)
m(Na2CO3·10H2O)=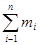 (Na2CO3·10H2O)
(Na2CO3·10H2O)
="2.86" g+0.486 g+0.0826 g+0.0140 g+……
="3.44" g
方法2(终态思维法):设最终析出Na2CO3·10H2O的质量为x,则其中含有Na2CO3和水的质量分别为:
m(Na2CO3)=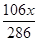 m(H2O)=
m(H2O)=
这样,若将(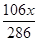 -1.06 g) Na2CO3溶解在质量为
-1.06 g) Na2CO3溶解在质量为 的水中,在题设温度下,当形成饱和溶液,所以:
的水中,在题设温度下,当形成饱和溶液,所以:
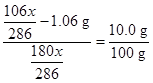 x=3.45 g。
x=3.45 g。
