问题
填空题
实验室模拟用工业废弃固体(含有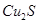 、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(
、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(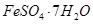 )和明矾[Kal(SO4)2
)和明矾[Kal(SO4)2 12H2O]的操作流程如下:
12H2O]的操作流程如下:

(1)试剂x是_________(写化学式)。
(2)配平下列方程式:
____
(4)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0g样品配成100mL溶液,移取25.00mL用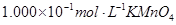 标准溶液进行滴定(MnO
标准溶液进行滴定(MnO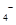 被还原为
被还原为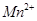 )。
)。
请回答下列问题:
①滴定时,KmnO4标准溶液应盛放在______________(填仪器名称)中。
②若达到滴定终点消耗KmnO4标准溶液体积为25.00mL,则该产品中铁元素的质量分数为_________。
答案
(1)H2SO4(或KHSO4)(2分)
(2)蒸发浓缩(或加热浓缩,或浓缩)、冷却结晶(4分)
(3)2、5、2、2、5、4(3分)
(4)①酸式滴定管(2分) ②14%(3分)
题目分析:(1)加入KOH后,溶液B含有K[Al(OH)4],而最后产物为明矾,所以X为H2SO4(或KHSO4)。
(3)根据化合价升降法即可配平化学方程式。
(4)①高锰酸钾具有强氧化性,能氧化橡胶管,只能盛放在酸式滴定管中;
②根据电子守恒可知:KMnO4→5Fe2+,20.0样品中含铁:0.025L×0.1mol/L×5×4×56g/mol=2.8g,进而求出铁元素的质量分数。
