(14分)工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:

请回答下列问题:
(1)反应①中生成的无色气体A是 ,滤液①的溶质是 。
(2)经测定NH4HCO3溶液呈中性,请分析原因(用离子方程式和文字表述说明理由)
。
(3)经反应②后,过滤得到的冰晶(Na3AlF6)固体,该固体上附着有杂质,需要洗涤,请简述如何证明冰晶石固体已经洗涤干净 。
(4)温度和NH4HCO3浓度会影响反应①的速率。现设计如下实验方案探究温度和NH4HCO3浓度对反应①速率的影响。请在表格空白处填写适当的反应条件。
| 实验编号 | 实验目的 | 温度 | c(NH4HCO3) |
| I | 为以下实验作参照 | 60℃ | c1 |
| II | 探究浓度对反应①速率的影响 | c2 | |
| III | 探究温度对反应①速率的影响 | 80℃ |


请分析t2℃时,滤液①中溶质的质量分数下降的原因是 。
(1)CO2 NH4F
(2)NH +H2O
+H2O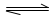 NH3·H2KO+H+
NH3·H2KO+H+
HCO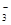 +H2O
+H2O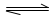 H2CO3+OH
H2CO3+OH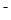
NH 和HCO
和HCO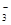 的水解程度基本相同
的水解程度基本相同
(3)取洗涤后的溶液,向其中滴加BaCl2溶液,无现象,说明已经洗涤干净;若有白色沉淀生成,说明没有洗涤干净。(其他方法合理给分)
(4)60℃ c1
(5)温度升高NH4F会分解(或答出NH4HCO3会分解也给分)
(1)碳酸氢钠能和氟硅酸反应生成二氧化碳气体、二氧化硅、氟化铵以及水,二氧化硅不溶于水,氟化铵易溶于水;
(2)NH4+和HCO3-均水解,前者水解显酸性,后者水解显碱性;
(3)经反应②后,过滤得到的冰晶(Na3AlF6)固体上附着有杂质硫酸铵,根据硫酸根的检验方法确定硫酸根的存在;
(4)对比实验的关键是控制变量法,当温度一定时,变化浓度,当浓度一定时,变化温度;
(5)氟化铵的性质和氯化铵相似,不稳定,受热易分解.
解:(1)碳酸氢钠能和氟硅酸反应生成二氧化碳气体、二氧化硅、氟化铵以及水,二氧化硅不溶于水,过滤后形成滤渣,氟化铵易溶于水,形成滤液,故答案为:CO2;NH4F;
(2)NH4+和HCO3-均水解,前者水解显酸性,后者水解显碱性,二者水解程度相同,溶液中氢离子浓度和氢氧根离子浓度相等,溶液呈中性,故答案为:NH4++H2O NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O H2CO3+OH-,NH4+和HCO3-的水解程度基本相同;
H2CO3+OH-,NH4+和HCO3-的水解程度基本相同;
(3)经反应②后,过滤得到的冰晶(Na3AlF6)固体上附着有杂质硫酸铵,硫酸根的检验方法:遇到钡离子产生不溶于硝酸的白色沉淀,来确定硫酸根的存在,只要硫酸根存在,沉淀就未洗涤干净,故答案为:取洗涤后的溶液,向其中滴加BaCl2溶液,无现象,说明已经洗涤干净;若有白色沉淀生成,说明没有洗涤干净;
(4)对比实验的关键是控制变量法,当温度一定时,通过变化浓度来分析浓度的影响,故Ⅰ和Ⅱ的温度相等,当浓度一定时,通过变化温度来分析温度的影响,故Ⅱ和Ⅲ温度不同,但浓度要相同,故答案为:60℃; c1;
(5)氟化铵的性质和氯化铵相似,不稳定,受热易分解(5)温度升高NH4F会分解,故答案为:温度升高NH4F会分解.
